Enzima catalasa
La catalasa en una enzima que la podemos encontrar en muchos organismos vivos, y cataliza la reacción de descomposición del peróxido de hidrógeno en agua y oxígeno.
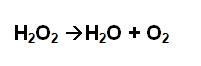
El peróxido de hidrógeno es uno de los productos del metabolismo celular en diversos organismos, pero dada su potencial toxicidad, es transformado enseguida por la enzima catalasa. Esta enzima es crucial para proteger a la célula de los daños oxidativos causados por el peróxido de hidrógeno. Sin la acción de la catalasa, las células estarían expuestas a altos niveles de estrés oxidativo, lo que puede llevar a daños en el ADN y otras moléculas esenciales para la vida celular.
En la industria, se también se utiliza la enzima catalasa, para diferentes fines. Por ejemplo, se usa en la industria textil, para eliminar residuos de peróxido de hidrógeno. También se utiliza en la industria alimentaria, para eliminar el peróxido de hidrógeno de la leche y el queso, y en la industria de la cerveza, para eliminar el peróxido de hidrógeno que puede afectar el sabor de la cerveza.
Además, la catalasa cumple una función protectora contra determinados microorganismos patógenos, sobre todo anaerobios. Las bacterias anaerobias, mueren al estar en contacto con oxígeno, es por esta razón que el oxígeno producido por esta enzima tiene efecto bactericida sobre estos microorganismos. Tanto es así, que la ausencia de dicha enzima por defectos genéticos, llamada acatalasemia o enfermedad de Takahara, causa importantes infecciones en la mucosa bucal, pudiendo llegar a causar la pérdida de dientes y graves lesiones en los maxilares y tejidos blandos de la cavidad bucal.
La reacción catalizada por esta enzima, ocurre en dos etapas, en las cuales interviene el hierro del grupo hemo de la hemoglobina como cofactor. En la primera etapa, la catalasa interactúa con una molécula de peróxido de hidrógeno para producir agua y un intermediario de oxígeno. En la segunda etapa, este intermediario de oxígeno interactúa con otra molécula de peróxido de hidrógeno para producir agua y oxígeno, regenerando la enzima para futuras reacciones.
La presencia de la enzima catalasa en los tejidos de los organismos, se puede demostrar en un sencillo experimento de laboratorio. Tomamos un trocito de hígado, y lo colocamos en el fondo de un tubo de ensayo. Luego añadimos 5 ml de agua oxigenada (que es lo mismo que peróxido de hidrógeno). Inmediatamente observaremos un intenso burbujeo, que se debe al desprendimiento de oxígeno de la reacción catalizada por la enzima catalasa.
Este sencillo experimento puede repetirse con distintos tejidos animales y vegetales, en los cuales encontraremos diferentes intensidades de burbujeo, dependiendo de la cantidad de catalasa presente en el tejido. Este experimento es una excelente manera de demostrar la presencia de enzimas y su función en los procesos biológicos.
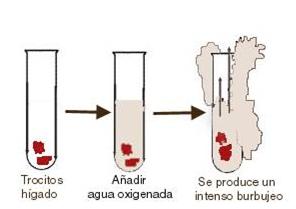
Todas las enzimas son proteínas. Por lo tanto, todas las enzimas sufren desnaturalizarción frente al calor. Esto quiere decir que cuando la temperatura es muy elevada, la enzima pierde su estructura terciaria, por lo tanto su sitio activo también se desnaturaliza, y ya no puede cumplir su función. Este hecho se puede demostrar repitiendo el experimento anterior, pero habiendo hervido previamente los trocitos de hígado. Cuando añadimos el agua oxígenada, no se observa el burbujeo.
La determinación de presencia o ausencia de catalasa resulta útil en el área de bacteriología, para diferenciar colonias de estreptococos, que son catalasa negativos, de estafilococos o micrococos, que son bacterias que contienen catalasa. Este método de identificación es muy útil en el diagnóstico de infecciones bacterianas, ya que permite a los médicos identificar rápidamente el tipo de bacteria que está causando la infección y seleccionar el tratamiento más adecuado.
También se utiliza para diferenciar los géneros Bacillus (catalasa positivo) de Clostridium (catalasa negativo). Estos dos géneros de bacterias son importantes en la industria alimentaria y farmacéutica, por lo que la capacidad de diferenciarlos rápidamente es esencial para garantizar la seguridad y la calidad de los productos.
Para realizar la prueba de la catalasa, se toma una colonia aislada del cultivo bacteriano y se coloca sobre un portaobjetos. Sobre ella se deja caer una gota de peróxido de hidrógeno. Si el resultado es positivo, se observará la formación de burbujas. Esta prueba es una herramienta valiosa en el laboratorio de microbiología, ya que proporciona una forma rápida y fácil de identificar bacterias basándose en su respuesta al peróxido de hidrógeno.
Si el cultivo bacteriano fue realizado en agar sangre, hay que tener precaución de no llevar un trozo de agar con el asa cuando se levanta la colonia, porque de esta manera se pueden dar resultados falso positivos. Este es un ejemplo de cómo los procedimientos de laboratorio deben llevarse a cabo con cuidado para evitar errores que puedan afectar los resultados.

