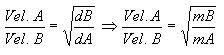Los Gases y Sus Características
Sabemos que la materia se presenta en la naturaleza en tres estados: líquido, sólido y gaseoso. Los gases tienen diferencias bien marcadas en relación a otros estados.
Propiedades de los Gases
El gas no tiene volumen Propio: Presenta volumen igual al del recipiente donde se contiene.
No posee forma propia: Asume la forma del recipiente donde lo coloquemos.
Tiene gran compresibilidad: Capacidad de reducción de volumen, como también de expansibilidad, esto es, capacidad de doblar de volumen dependiendo de la presión a la que está sometido.
* En la licuefacción de un gas existe contracción de volumen
* La vaporización se caracteriza por el aumento de volumen
El gas posee Variables: V (Volumen); P (Presión); T (Temperatura)
La Presión es medida en atmósferas (atm.) y también puede ser medida en mm de Hg (milímetros de mercurio). A nivel del mar, ella equivale a la columna de Hg de 760 mm de alto.
Temperatura
Existen varias escalas: las mas importantes como hemos mencionado en otros artículos son Celsius, Kelvin y Farenheit. La temperatura absoluta es la medida de una escala cuyo cero es el más absoluto (la más baja temperatura que existe equivale a cero grado en la escala Kelvin).
Volumen
Se utilizan las unidades usuales de volumen (L, dm3)
Relación y Ecuaciones al respecto de las variables
- La relación entre Presión y Volumen Gaseoso
Un gas de masa fija, cuya temperatura es constante, tiene volumen inversamente proporcional a la presión del gas.
pV = K K = constante
- La relación entre el volumen gaseoso y temperatura
Existe una relación directamente proporcional entre el volumen de la masa, fija a presión constante y la temperatura absoluta del gas:
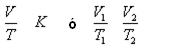
Transformaciones Isobáricas: Existe constancia de presión y cambios de temperatura y volumen.
- Relación entre Peso y Temperatura de un Gas
Entre la temperatura absoluta de un gas y la presión de su masa fija, la constante es también directamente proporcional.
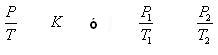
Cuando ocurren variaciones de presión y temperatura, pero existe constante de volumen, las transformaciones son llamadas isocóricas, isométricas o isovolumétricas.
Gas Ideal y Gas Real
A continuación el modelo teórico ilustrado debajo, exactamente como el de las leyes químicas. El gas ideal no existe realmente. Los gases reales, o existentes, se aproximan de esa exactitud matemática.
Gas ideal – Gas real – Transformaciones:

Ecuación General – Gases Ideales
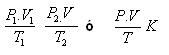
K = significa una constante
Gas en las condiciones normales – Temperatura y presión normales
Siglas usadas = C.N.T.P (condiciones normales de temperatura y presión)
Volumen normal
El mol en el gas ideal, cuando se aprecia C.N.T.P. (condiciones normales) tiene volumen = 22,4 litros en 1 mol de sustancia.
Ecuación
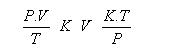
Constante Universal de los Gases
Es el caso en que el número de moléculas del gas es igual a un mol. Está representada por R. Cuando las condiciones de temperatura y de presión en gases cualesquiera son normales, existiendo también volúmenes iguales, el número de moléculas de ese volumen (V) es el mismo – en los gases ideales es aproximado a los gases reales. Esa es la Hipótesis de Avogadro.
Mezcla Gaseosa
Los gases son sometidos a presiones (presión corresponde a una variable de los gases). En las mezclas, cada gas sufre la presión como si estuviese solo – a esta condición se le da el nombre de presión parcial -. Ya la presión total de la mezcla gaseosa, representa la suma de las presiones parciales de los gases, principalmente de la mezcla.
Los gases en cuanto a la Densidad
Densidad Absoluta
Es el resultado de la división de la masa por el volumen. En el caso de la molécula, significa también la división entre masa y volumen.
Densidad Relativa
Se trata de un número puro, resultante de relaciones de la misma magnitud.
Las mezclas gaseosas – Características y Propiedades
Difusión
Fenómeno a través del cual los gases se mezclan de forma rápida y homogénea, formando un sistema monofásico. Cuando ocurre su salida a la atmósfera, ellos se esparcen, vale decir, se difunden.
Efusión
La efusión de los gases se da por el pasaje de los gases a través de pequeños orificios. La velocidad del fenómeno efusión (también válidos para la difusión) está dada por la Ley de Graham:
La velocidad de efusión o difusión se da en proporción de sus densidades
Densidad – Relación entre masas molares
Ecuación de la Ley de Graham o de la Velocidad