Estados de agregación y fuerzas intermoleculares
Para poder describir ciertas propiedades de la materia, como los estados de agregación (sólido, líquido y gaseoso), la temperatura de ebullición y de fusión, la viscosidad, la solubilidad, la densidad, etc., es necesario considerar las fuerzas que mantienen unidas a las partículas que constituyen cada una de las sustancias. A estas fuerzas las denominamos fuerzas intermoleculares, para diferenciarlas de las intramoleculares (principalmente enlaces iónicos, metálicos o covalentes), que mantienen a los átomos unidos dentro de la molécula.
Las fuerzas intramoleculares necesitan superarse para que ocurra un cambio en la composición química del sistema (la sustancia ya no será la misma), por lo tanto, son las que establecen las propiedades químicas de las sustancias.
Las fuerzas intermoleculares, en cambio, que afectan las moléculas o iones y que producen que se atraigan o se repelan, son las que establecen las propiedades físicas. Por ejemplo, al pasar una sustancia de sólido a líquido hay un cambio de estado, pero la sustancia sigue siendo la misma. Usualmente son fuerzas débiles (generalmente tienen una intensidad de menos del 15% de la de los enlaces covalentes o iónicos), pero por su gran número, su aporte es significativo.
Tipos de fuerzas
Entre moléculas neutras pueden diferenciarse tres fuerzas de atracción: fuerzas dipolo-dipolo, de dispersión de London y puente de hidrógeno. Otro tipo de fuerza de atracción, la ión-dipolo, es importante en las disoluciones.
Los cuatro tipos de fuerzas, son de naturaleza electrostática, es decir, implican atracciones entre especies positivas y negativas, y dependen de la composición y de la polaridad de las moléculas.
¿Cómo averiguamos la polaridad de una molécula?
Puede conocerse si una molécula es polar (posee un extremo con densidad de carga positiva y otro con densidad de carga negativa) o apolar, de acuerdo a su geometría, por lo cual tenemos que analizar su estructura de Lewis.
Recorriendo el camino:
Lewis → geometría → polaridad → fuerzas intermoleculares → propiedad física
puede conocerse si una sustancia tendrá mayor o menor punto de ebullición que otra, e incluso ordenar varias sustancias con respecto a su punto de fusión o ebullición.
Veamos la siguiente propiedad física y su relación con las fuerzas intermoleculares:
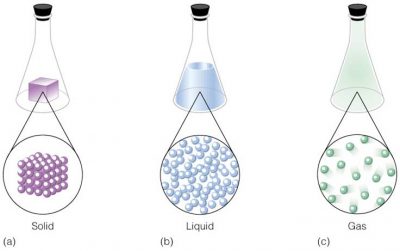
Estados de agregación
El estado de agregación de una sustancia depende, en gran medida, del balance entre las energías cinéticas de las partículas y las energías de atracción entre ellas. Las energías cinéticas, que dependen de la temperatura, tienden a mantener a las partículas separadas y en movimiento, y las atracciones entre partículas, tienden a juntarlas.
Las moléculas de un líquido deben vencer sus fuerzas de atracción para separarse y formar un vapor. Cuanto más intensas son las fuerzas de atracción, más alta es la temperatura a la que el líquido ebulle. Asimismo, el punto de fusión de un sólido aumenta al incrementarse la intensidad de las fuerzas entre las moléculas.
Es importante aclarar, que las fuerzas intermoleculares son uno de los factores que influyen en las propiedades físicas de un sistema, pero existen otras variables, por ejemplo, la presión, la masa molecular, etc, que se deben tener en cuenta al analizar las propiedades y cambios de una sustancia determinada o al compararla con otras.