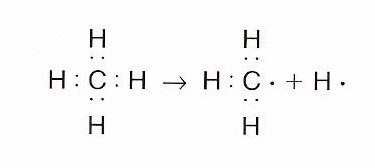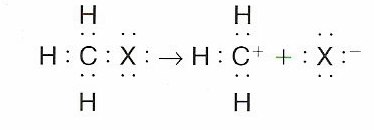Clases de reacciones orgánicas
Debido a la enorme cantidad y diversidad existente de compuestos orgánicos, se hace comprensible que las reacciones que tienen lugar entre ellos sean también bastante variadas. Sin embargo, las reacciones pueden encontrarse clasificadas en unos pocos grupos principales, pero para conocerlos primero debemos saber las formas de ruptura que tienen lugar en los enlaces, así como las clases de reactivos que pueden verse involucrados en las reacciones.
Ruptura de enlaces:
Las reacciones suponen que se lleve a cabo una ruptura de alguno de los enlaces que intervienen en las moléculas de las sustancias que reaccionan y la reordenación de los electrones de valencia para formar nuevos enlaces en los productos que da la reacción. Dichas rupturas, por lo general, pueden ocurrir en dos formas: ruptura hemolítica, y ruptura heterolítica.
Ruptura homolítica: Tiene lugar cuando un enlace de tipo covalente A:B se ve roto de manera que cada uno de los átomos se queda con un electrón del par del enlace. De esta manera, se consiguen dos radicales libres.
Dichas especies son neutras eléctricamente hablando, poseen un electrón que se encuentra desapareado, son bastante reactivas y cuentan con una vida media bastante corta.
La ruptura del enlace A:B tiene lugar así:
AB → A: + B∙
Ejemplo:
Este tipo de ruptura suele darse en compuestos que cuentan con una baja o incluso nula, polaridad y necesitan un suministro de energía que corresponda con la disociación del enlace.
Por esto, para poder iniciar la reacción a través de radicales libres se necesita un alto aporte a nivel energético. Dicha aportación puede llevarse a cabo a través de una vía térmica o también siguiendo un suministro de radiaciones. Estas reacciones generalmente tienen lugar en fase o estado gaseoso, o encontrándose en disolución con disolventes que sean no polares.
Ruptura heterolítica:
Se realiza cuando el enlace covalente A:B se rompe de maera que uno de los dos átomos que forma en enlace se quede con el par de electrones de este. De esta manera se consiguen dos iones, uno será positivo y el otro negativo.
La ruptura del enlace A:B se sucede así :
A:B → A+ + :B-
Ejemplo:
Cuando un carbono consigue conservar los dos electrones, el ion resultante recibe el nombre de carbanión R-, y en cambio, cuando los pierde se le denomina carbocatión R+. Es más frecuente la formación de un carbocatión que de un carboanión.
La ruptura heterolítica en un enlace covalente tiende a producirse en moléculas con una gran polaridad. Esta ruptura tiene lugar en condiciones más suaves que la ruptura homolítica, y por lo general, se da en presencia de disolventes polares que consiguen estabilizar a los iones.
Ya sean los radicales libres formados a partir de la ruptura homolítica como los iones que se dan en la ruptura heterolítica, reciben ambos el nombre de intermedios de reacción, e intervienen de manera general en los mecanismos de las reacciones de tipo orgánicas a modo de reactivos intermedios.
Clases de reactivos:
Es normal en las reacciones de la química orgánica llamar sustrato y reactivo a las distintas sustancias que participan en las reacciones. La molécula que reacciona, generalmente es la mayor, y se llama sustrato. Esta será atacada por otra molécula, por lo general más pequeña, llamada reactivo, que dará lugar a la reacción química al interaccionar con el sustrato. Dicho reactivo, puede ser de distintas naturalezas, inorgánico, radical libre, electrófilo o nucleófilo.
– Radicales libres: se producen en las reacciones homolíticas, son bastante reactivos e interaccionan con otros tipos de radicales o con moléculas de tipo neutro. Los radicales en química orgánica se llaman primarios, secundarios o terciarios, dependiendo de la naturaleza que tenga el carbono que cuente con el electrón no apareado. Los radicales terciarios son los que mças estabilidad poseen, y por lo tanto, son menos reactivos.
– Reactivos electrófilos: Son reactivos con alguno de sus átomos de poca densidad electrónica, por lo cual suelen actuar sobre los átomos del sustrato que tienen carga negativa, o una alta densidad de carga. Los reactivos electrófilos siempre son cationes u otras moléculas que tienen algún orbital atómico sin ocupar, como por ejemplo H+, BF3, SO3, etc.
– Reactivos nucleófilos: Son reactivos que tienen algunos de sus átomos con una alta densidad de carga, por lo que suelen actuar en los átomos del sustrato que tenfa carga positiva o un deficit de carga. Por lo general son aniones o neutros con electrones libres, por lo tanto, ceden electrones. Es el caso del H-, OH-, CN-, etc.
Principales tipos de reacciones orgánicas:
Si tenemos en cuenta la relación que existe entre el sustrato y los productos de la reacción, podemos distinguir diferentes tipos de reacciones orgánicas. Destacamos las reacciones de sustitución, de adición, de eliminación, de condensación, así como las reacciones de polimerización.
–Reacciones de sustitución: Son reacciones donde un átomo o varios átomos de un reactivo se meten en la cadena de carbonos que forma al sustrato, consiguiendo cambiar alguno de los átomos que se encuentran unidos al carbono.
R-X (sustrato) + Y ( reactivo) → R-Y + X
Según el tipo de ruptura que se cree en los enlaces, la sustitución podrá ser homolítica o heterolítica. La más frecuente es la sustitución heterolítica, la cual además puede ser nucleófila o electrófila (SN1, SN2, E1, o E2).
– Reacciones de adición: Se conocen como reacciones de adición a aquellas donde dos átomos que se encuentren unidos a través de enlaces dobles o triples, cuando se han roto, se unen a otros tipos de átomos a través de enlaces simples. Estas adiciones pueden ser nucleófilas o electrófilas.
– Reacciones de eliminación: Las reacciones de eliminación son en las cuales la molécula que forma el sustrato sufre una perdida de dos átomos o grupos de ellos, que se encuentran enlazados a su vez a dos átomos de carbono adjunto, formándose entre ellos un enlace tipo π. Son las reacciones contrarias a las de adición.
– Reacciones de condensación: Estas reacciones suceden cuando dos o más de las moléculas orgánicas se enlazan a través de una eliminación molecular.
–Reacciones de polimerización: Estas reacciones tienen una alta importancia en la práctica, pues dan lugar a la formación de sustancias poliméricas, es decir, moléculas con un gran tamaño, resultantes de unir muchas moléculas en una sólo, que por lo tanto será más compleja.