Modelo atómico de Rutherford
 Ernest Rutherford, o Lord Rutherford como también fue conocido, puede ser considerado el padre da la física nuclear y de la química de los átomos. Antes de su famoso experimento, la comunidad científica mundial creía sin problema alguno, en el modelo atómico de Thomson, un modelo muy simple en el cual había sólo electrones de carga negativas, incrustados en un átomo de carga positiva, como pasas en un budín cualquiera.
Ernest Rutherford, o Lord Rutherford como también fue conocido, puede ser considerado el padre da la física nuclear y de la química de los átomos. Antes de su famoso experimento, la comunidad científica mundial creía sin problema alguno, en el modelo atómico de Thomson, un modelo muy simple en el cual había sólo electrones de carga negativas, incrustados en un átomo de carga positiva, como pasas en un budín cualquiera.
Pero el experimento de Rutherford encontró algo muy raro en los resultados del experimento, algo que iba en sentido contrario con respeto de lo que decía el modelo de atómico de Thomson. Rutherford utilizo una fina lámina de oro como objetivo para rayos alfa, es decir, un flujo de partículas formadas por núcleos ionizados de Helio-4 (4He), o lo que es lo mismo, partículas positivas que carecen de electrones, que eran disparadas hacia la lámina de oro. El experimento de Rutherford tenía como objetivo el estudio de efecto que producía en los diferentes metales la trayectoria de dichos rayos. A este experimento se le conocía con el nombre de
“experimento de la lámina de oro”, y fue realizado en 1911.
Ernest Marsden y Hans Geiger (que bautiza unos años después el famoso contador Geiger), bajo el control de Rutherford, estudian algo muy estraño: descubieron que muchos rayos alfa se iban directos hacia el frente sin modificar su trayectoria, tan sólo algunos rayos que rebotaban hacia atrás, y esto fue lo que les sorprendió. ¿ Qué provocaba este estraño comportamiento?, ¿ de qué dependía el rebote?.
En el modelo atómico de Thomson, este comportamiento no tenía sentido alguno.
A Lord Rutherford se le ocurrió entonces lo que quizás fue la intuición más importante de toda su exitosa carrera, su hipótesis era que en el centro del átomo había un pequeño, pero muy duro espacio central, que hacía rebotar los rayos alfa hacia atrás.
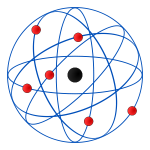
Gracias a estas observaciones, Rutherford construyó un segundo modelo atómico en el cual, el centro del átomo (de carga neutra) estaba formado por un núcleo positivo, y en los alrededores de éste, se encontraban algunas partículas negativas (los electrones de Thomson) que orbitaban en círculo alrededor del núcleo.
El núcleo tenía que estar constituido por una misteriosa y desconocida partícula con carga positiva, que Ernest Rutherford llamó protón. Este modelo podía explicar como las partículas alfa, que eran núcleos de un átomo como el Helio, que tenía tan sólo dos protones (y dos neutrones, partículas que por aquellos tiempos aún eran desconocidas), y era más ligero que el núcleo de oro, siendo esta la causa por la cual, las partículas alfa rebotaban. Las partículas que no pasaban por el centro del átomo, si no que lo hacían por las “nubes de electrones” tenían un trayecto modificado, porque los electrones se movían y circulaban con una velocidad próxima a la de la luz alrededor del núcleo.
Pero también en este elegante modelo había unos cuantos problemas.
Se teorizaba que los electrones circulaban alrededor del núcleo porque su velocidad y su aceleración o fuerza centrifuga, era de intensidad igual a la atracción electromagnética que el núcleo positivo ejercía sobre los electrones negativos. Pero este equilibrio tendría que ser provisional, ya que la velocidad de los electrones debería diminuir con el tiempo y colapsar hacia el núcleo positivo del átomo.
El modelo atómico de Rutherford fue rápidamente sustituido por Bohr, que consiguió resolver algunas preguntas que este modelo dejaba en el aire sin responder.

