Modelo atómico de Bohr
 La nueva concepción de la luz y la energía, motivó al físico danés Niels Bohr, a dar una explicación al hecho que constituyó el espectro de emisión de los gases, basándose concretamente en el átomo de hidrógeno, dio lugar en 1913, a un nuevo modelo atómico, llamado modelo atómico de Bohr o también conocido como de Bohr-Rutherford, el cual puede ser considerado el precedente del modelo atómico actual. Se trata de un modelo más que nada funcional, ya que no habla del átomo en sí, sino que da explicación a su funcionamiento mediante ecuaciones.
La nueva concepción de la luz y la energía, motivó al físico danés Niels Bohr, a dar una explicación al hecho que constituyó el espectro de emisión de los gases, basándose concretamente en el átomo de hidrógeno, dio lugar en 1913, a un nuevo modelo atómico, llamado modelo atómico de Bohr o también conocido como de Bohr-Rutherford, el cual puede ser considerado el precedente del modelo atómico actual. Se trata de un modelo más que nada funcional, ya que no habla del átomo en sí, sino que da explicación a su funcionamiento mediante ecuaciones.
Bohr basaba su modelo atómico en los siguientes principios:
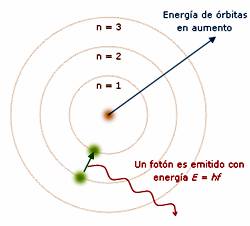
- El electrón se mueve entorno al núcleo formando órbitas circulares. El espacio que está entorno al núcleo se dice que está cuantizado, lo que significa que, hay partes, o zonas permitidas, conocidas como niveles, y otras que no. Si un electrón no cambia de órbita, no cambia tampoco su energía.
- Las orbitas permitidas son en las que, el momento angular del electrón ( mvr), es múltiplo de h/2π de donde h es la constante de Planck. m v r = n. h/ 2π , de donde n es el número cuántico principal, y determina los niveles entorno al núcleo, numerados a partir del núcleo, n= 1,2,3,… , lo que significa que la energía y los radios de las órbitas están cuantizados.
- Cuando un átomo emite o absorbe energía, lo realiza mediante cuantos completos de valor h.ν , y esto es debido a que el electrón experimenta un tránsito entre niveles, que se puede resumir en :
E2 – E1 = hν
de donde, E1= energía del nivel inicial y E2 = energía del nivel final.
-El átomo absorbe energía si E2 > E1
-El átomo emite energía si E2 < E1
El modelo atómico que Bohr propuso, explicaba los espectros de emisión de los elementos y afirmaba la expresión empírica que había conseguido Rydberg. Explicaba el núcleo del átomo de hidrógeno con un protón en él, y girando a su alrededor un electrón. El modelo que Bohr creó llevando su nombre, partía de la idea del modelo de Rutherford, usando conceptos estudiados por Max Planck y Einstein, años antes.
Gracias a lo simple que es este modelo, aún en la actualidad se usa para resumir la estructura de la materia.
Los electrones giraban en órbitas circulares entorno al núcleo, donde ocupaban la menor energía posible, que también podía ser la órbita más cerca del núcleo.
Bohr supuso que los electrones se movían únicamente en ciertas órbitas, cada una de ellas estaba caracterizada por un nivel de energía diferente. De este modo, cada órbita de conocía con un número entero, que iban desde el número 1 en adelante, donde “n” era el número cuántico principal. Bohr consiguió superar el problema del electromagnetismo clásico que decía que una partícula cargada se movía circularmente emitiendo energía, por lo que los electrones deberían chocar con el núcleo en poco tiempo.
El éxito de este modelo fue fugaz, porque no explicaba algunas propiedades periódicas de los elementos, y su hipótesis principal, por lo cual, no tenía amparo teórico.
Más tarde, con el uso de espectroscopios precisos, se vieron dos fenómenos a los cuales no podía dar explicación:
– Algunas líneas del espectro eran dobles, triples, etc., pero muy próximas, de manera que al observarlas desde espectroscopios menos precisos se confundían con una misma línea.
– P. Zeeman, un físico holandés, en 1896, vio que cada línea espectral se dividía en dos, al someter las muestras a un campo magnético de gran intensidad. A esto se le conoce como efecto Zeeman.
