La difusión de gases y derrame
Considerando que un recipiente contenga gas, si su olor se esparciese todos que estuviesen alrededor, sentirían un fuerte olor a gas (hecho muy conocido). Ese hecho ocurre, porque las moléculas de un gas se mueven con facilidad a través de los espacios vacíos entre las moléculas, provocando que ella se mezcle uniformemente con ellos.
Podemos pensar también que esas moléculas pueden atravesar las paredes porosas, sin embargo no todas en la misma velocidad, independiente si los gases están o no en las mismas condiciones de temperatura y presión.
Difusión de gases – es la forma en que los gases atraviesan una pared porosa, y en ese mismo proceso se mezclan de manera uniforme con otros gases.
Sin embargo, el derrame de gases se conceptualiza como una forma en que un gas escapa de un recipiente, a través de un pequeño agujero, hacia el vacío.
Thomas Graham fue un químico británico, que estudió el derrame de gases, el creó la ley que lo explica.
“Las velocidades de derrame de los gases son inversamente proporcionales a las raíces cuadradas de sus masas específicas, cuando sometidos a la misma presión y temperatura.”
Densidad relativa del gas G1 en relación al gas G2
La densidad relativa entre esos gases (G1 G2) es el cociente existente entre la densidad exacta de G1 y la densidad exacta de G2, que fueron medidas con la misma presión y temperatura.
Observe:
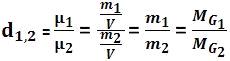
Pero la densidad relativa no depende de la presión y de la temperatura.
En relación al aire dGar, la densidad relativa del gas, tenemos:

Densidad de gas en relación con hidrógeno :
Independiente de la presión de la temperatura tendremos:
Observe:
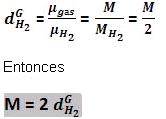
Densidad absoluta o masa específica de un gas
La densidad absoluta o masa específica de u gas es determinada por la presión y temperatura de un cociente existente entre la masa de gas y un volumen de él.
![]()
Véalo en condiciones normales:
En determinada temperatura:

La densidad es proporcional a su propia presión, ya a su temperatura absoluta es contrariamente proporcional.
Condiciones normales de temperatura y presión (CNTP)
La temperatura normal hace algunos años era 0°C, ya la presión normal era de 1 atm. Considerando esos valores, tenemos que el volumen molal de los gases es 22,4 L.
Donde:
T = 0ºC = 273K
P = 1 atm = 760mmHg = 101325Pa
Volumen de los gases = 22,4L/mol
Actualmente IUPAC modificó el valor presión normal para 100000Pa. A 0ºC y 100000Pa el volumen de 1 mol de gas es 22,7L.
Observe:
CNTP
P = 100000Pa → volumen molar de los gases = 22,7/molal.
Densidad de los gases
La relación entre la masa y el volumen es que determina la densidad de una sustancia (d o u).
![]()
Normalmente la densidad de los sólidos y líquidos son expresadas en g/L, por ejemplo, el gas cloro posee densidad de 25ºC y atm, o sea 2,92g/L.

