Ión poliatómico
Un ión poliatómico es un grupo de dos o más átomos que están químicamente unidos y tienen carga positiva o negativa, y que son considerados como una unidad en las reacciones químicas.
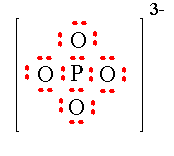
Los iones poliatómicos más comunes tienen carga negativa. Esto significa que el grupo de átomos ha ganado electrones. Por ejemplo, el ión fosfato, PO43- ha ganado tres electrones extra (además de los que ya tenían los átomos de fósforo y oxígeno).
Estos electrones son compartidos por todos los átomos del ión poliatómico.
En el siguiente esquema observamos una representación del ión fosfato, con la carga negativa fuera del paréntesis, indicando que estos tres electrones son compartidos.
En la siguiente tabla tenemos algunos de los iones poliatómicos más comunes y su fórmula. (nomenclatura antigua).

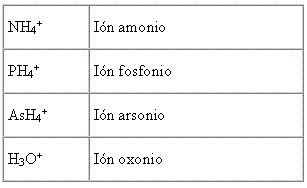
El ión poliatómico con carga positiva más común es el amonio NH41+.
En la mayoría de los iones poliatómicos, existe un átomo central, en cuyo derredor se sitúan los demás átomos.
Muchas veces son átomos de oxígeno los que rodean el átomo central, y en este caso el ion es llamado oxoanión. Muchos oxoaniones son bases débiles y reaccionan con hidrógeno para formar ácidos o sales ácidas, tal es el caso del ácido sulfúrico H2SO4 y el ácido nítrico HNO3.
Los oxoaniones también pueden formar bases fuertes, como KOH (hidróxido de potasio) o soda cáustica NaOH.
Nomenclatura de los iones poliatómicos.
Hay algunos compuestos que tienen electrones libres, y reaccionan con hidrógeno, cediéndole estos electrones y transformándose en cationes poliatómicos. Para nombrar estos cationes se añade la terminación –onio, como se ve en la siguiente tabla:
Los iones poliatómicos más comunes son los oxoaniones, formados por un átomo central y varios átomos de oxígeno. La nomenclatura moderna los nombra a todos agregando el sufijo –ato al nombre del elemento central y entre paréntesis, en números romanos, el número de oxidación del átomo central.
Ejemplo:
SO42- sulfato (VI)
SO32- sulfato (IV)
Algunos oxoaniones se protonan parcialmente, y para nombrar dichos aniones debemos agregar al principio la palabra hidrógeno.
Si se protonan con más de un átomo de hidrógeno, de debe indicar con el prefijo “ di” o el que corresponda. Por ejemplo:
• oxoanión fosfato (V) PO43-
• oxoanión hidrógeno fosfato (V) HPO42-
• oxoanión dihidrógeno fosfato (V) H2PO4–
