Teoría de los enlaces químicos y estructura de los complejos y quelatos
La estructura de los complejos y quelatos se asemejan en varios aspectos y será presentada de acuerdo con la teoría de los orbitales atómicos.
En la molécula o ion complejo, existe un átomo metálico central que es denominado átomo o ion central y un determinado número de grupos coordinados enlazados al átomo central que son denominados enlazantes y situados dentro de una región que se acostumbra llamar “esfera de coordinación”.
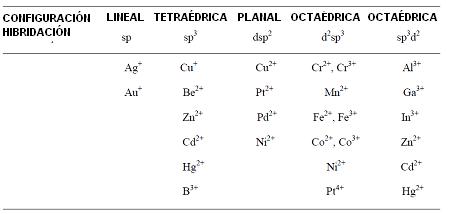
Al número de agrupamientos dadores que el átomo puede acomodar, se ha hecho convención llamarlos como “número de coordinación” ó “índice de coordinación” del átomo metálico central.
Se puede admitir que el número de coordinación corresponde al número de orbitales híbridos y disponibles para enlaces que el átomo central presenta. De acuerdo con las propias características de la estructura extranuclear de los átomos, pueden ocurrir diferentes tipos de hibridaciones, resultando un número variable de orbitales disponibles y por tanto diversos valores para el “número de coordinación”.
En el cuadro a continuación son presentados los valores más comunes del número de coordinación, el tipo de configuración y los orbitales híbridos que forman parte en en enlace, para diversos átomos.
Los enlaces entre los ligantes y el átomo central, en los iones complejos son predominantemente coordinados, al contrario de covalentes, una vez que los cationes metálicos ya son deficientes en electrones, esto es, tienen carácter electropositivo.
Por esta razón, la mayoría de los cationes metálicos tiende a atraer moléculas polares e iones cargados negativamente que contengan pares aislados de electrones. La atracción es tan fuerte que a no ser que los cationes sean de los elementos IA y IIA de la clasificación periódica, todos los demás se presentan en solución, en la formación de cationes complejos. Esto significa que en lugar de cationes comunes, aparecen iones complejos formados del catión metálico y de moléculas del solvente. Sirven de ejemplo los cationes:
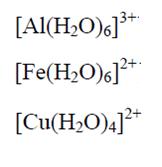
Entre otros, en el caso del solvente ser el agua. Con otros solventes, como amoníaco líquido, ácido acético glacial, éter, acetona, etc., un catión sufriría una solvatación, de forma similar a lo que ocurre con el agua (hidratación).
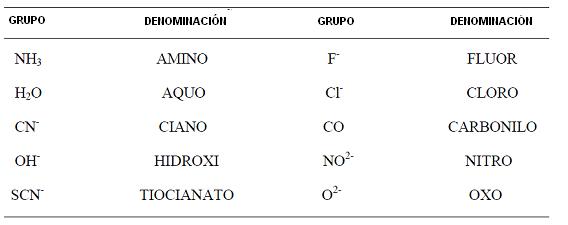
Los grupos coordinados o ligantes, que pueden llenar la esfera de coordinación de un ion metálico, pueden ser de varios tipos. En el cuadro debajo son presentados los más comunes, que son del tipo monodentado, esto es, típicos formadores de complejos:
Con el objetivo de esclarecer la estructura de iones complejos conforme a la teoría de los orbitales atómicos es presentado un ejemplo del complejo de cobalto con amoníaco.
![]()
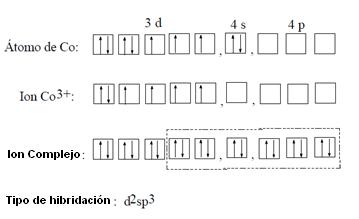
El átomo de cobalto (Co = 27) tiene una configuración electrónica 1s2, 2s2, 2p6, 3s2, 3p6, 3d7, 4s2. Transformándose en un ion trivalente, el cobalto pierde dos electrones del orbital 4s y un electron de uno de los orbitales 3d, adquiriendo otra configuración. Cuando el ion de cobalto va a combinarse con las seis moléculas de amoníaco, existe una predisposición de los electrones en los orbitales 3d.
Así, hay un apareo de los electrones de los orbitales 3d, de forma de dejar libres dos orbitales para el proceso de hibridación. Se originan así, 6 orbitales híbridos representados por d2sp3, porque son provenientes de la combinación de dos orbitales d un s y tres p.
Las aclaraciones presentadas para explicar la unión de los ligantes al átomo o ion central se fundamentan en el concepto de orbital atómico. Sin embargo, otra teorías como la de los orbitales moleculares, de la atracción electroestática y la del campo cristalino, han sido desarrolladas para demostrar la estructura de los complejos.
