Diagrama de Lewis
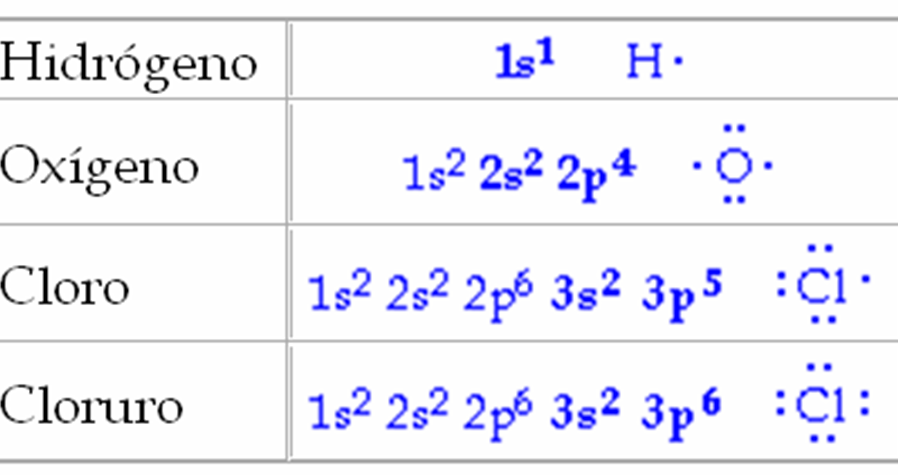
Un símbolo de Lewis es un símbolo en el cual los electrones de la capa de valencia de un átomo o de un ión simple son representados por puntos colocados alrededor del símbolo del elemento. Cada punto representa un electrón. Por ejemplo:
Repara en los ejemplos que te presentamos en el que el Cloro posee siete electrones de valencia, en tanto que el cloruro tiene ocho.
Un enlace covalente es aquel enlace químico formado por el compartmiento de un par de electrones entre dos átomos. La estructura de Lewis de un compuesto covalente o de un ión poliatómico muestra como los electrones están distribuidos entre los átomos, de forma de mostrar la conectividad entre ellos.
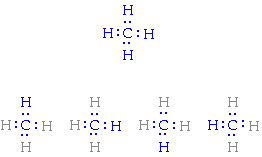
En el caso del metano, por ejemplo, cuatro electrones, uno de cada hidrógeno, más los cuatro electrones de valencia del carbono, son emparejados en la Diagrama, mostrando como cada átomo se conecta a otro por un par de electrones.
En vez de utilizar dos puntos para indicar el par de electrones que perpetuan el enlace covalente, podemos utilizar un trazo. Así, el trazo irá a representar dos electrones del enlace covalente.
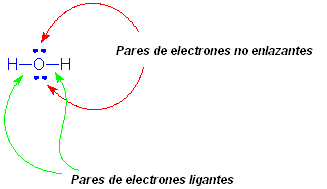
Vamos a representar ahora el diagrama de Lewis del agua. Dos hidrógenos son enlazados al átomo de oxígeno central. Los electrones del enlace son indicados por las líneas entre el oxígeno y cada uno de los hidrógenos. Los electrones remanecientes (dos pares) que constituyen el octeto del oxígeno, son llamados de no enlazantes, por no estar involucrados en enlaces covalentes.
El primer paso para dibujar una estructura de Lewis y determinar el número de electrones de valencia de los átomos que serán conectados. Después es necesario determinar cual es el átomo central y enlazarlo a los átomos periféricos por pares de electrones.
Consideremos el dióxido de carbono CO2
El carbono (C) tiene cuatro electrones de valencia x 1 carbono = 4 e-
El oxígeno (O) tiene seis electrones de valencia x 2 oxígenos = 12 e-
Existe un total de 16 e- para ser colocados en el Diagrama de Lewis
Conectamos el átomo central a los otros átomos en la molécula con enlaces simples.
El carbono y el átomo central, los dos oxígenos son ligados a el; pero más adelante vamos a sumar más electrones para completar los octetos de los átomos periféricos.
Hasta aquí fueron utilizados cuatro electrones de los 16 a disposición. Entonces completamos la capa de valencia de los átomos de la periferia de la molécula.
Fueron utilizados todos los 16 electrones disponibles. Colocamos cualesquiera electrones remanecientes sobre el átomo central. No existen más electrones disponibles en este ejemplo.
Si la capa de valencia del átomo central está completa, entonces hemos dibujado un diagrama de Lewis aceptable. El carbono esta deficiente de electrones, solo teniendo 4 en su entorno. Esta no es un diagrama de Lewis aceptable entonces
Si la capa de valencia del átomo central no está completa, usa un par solitario de uno de los átomos de la periferia para formar un doble enlace de aquel átomo con el átomo central. Continúe el proceso de realizar múltiples enlaces de los átomos periféricos con el átomo central, hasta que la capa de valencia del átomo central esté completa.
Certificamos que hayamos utilizado el número correcto de electrones en el Diagrama de Lewis. Recuerde que algunos elementos, como el azufre, por ejemplo, pueden ampliar su capa de valencia para más de ocho electrones.
El mejor diagrama de Lewis que puede ser escrita para el dióxido de carbono es: