Oxoaniones
Un oxoanión es un ión poliatómico, constituido por un átomo central de un elemento (generalmente no metal, pero pueden ser elementos de distintos grupos de la tabla periódica) y uno o varios átomos de oxígeno. Como todos los aniones, los oxoaniones tienen carga negativa, dado que han ganado uno o varios electrones. Estos electrones son compartidos por todos los átomos integrantes del oxoanión.
Oxoaniones simples.
Los oxoaniones simples tienen una estructura AOnm−, siendo A el elemento central del anion. La fórmula de los oxoaniones simples sigue la regla del octeto, formulada por Lewis: “Un átomo diferente del hidrógeno tiende a formar enlaces ganando, perdiendo o compartiendo electrones, hasta quedar rodeado por ocho electrones de valencia”. Esto se aplica sobre todo para los elementos del segundo período de la tabla periódica, pues tienen orbitales 2s y 2p, capaces de contener ocho electrones. De todas maneras hay excepciones a la regla del octeto, por ejemplo moléculas con número impar de electrones. Estas moléculas son muy reactivas, ya que tienen a usar el electrón solitario para formar enlaces.
Ejemplos de oxoaniones de elementos del segundo período de la tabla, son los siguientes:
NO3− ion nitrato
CO32− ion carbonato
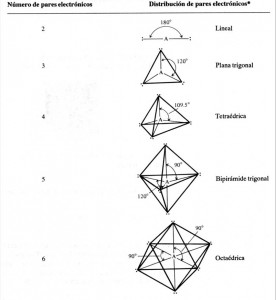
La estructura de estos aniones es pirámide trigonal. Cada átomo de oxígeno comparte un par de electrones con el átomo central, y los pares de electrones compartidos se alejan a la máxima distancia posible, dado que sus cargas negativas se repelen. Entonces, al haber tres pares de electrones compartidos, la distancia entre cada uno de ellos es de 120 grados.
En el caso de los iones NO2− , la estructura es lineal; al haber sólo dos pares de electrones compartidos, éstos se disponen uno a cada lado del elemento central.
Los oxoaniones formados con los elementos del tercer período de la tabla, con el número de oxidación principal del grupo, son tetraédricos. Algunos ejemplos son:
SO42− ion sulfato
PO43− ion fosfato
En algunos casos, los oxoaniones formados con estos elementos cumplen la regla del octeto. Por ejemplo el cloro (V) tiene solo dos electrones de valencia, por lo que puede compartir tres pares de electrones al reaccionar con oxígeno, por lo tanto se forma el oxoanión ClO3− ion clorato.
Oxoaniones condensados.
Algunos oxoaniones, con carga alta, pueden sufrir una reacción de condensación, como sucede en la formación del el ion dicromato:
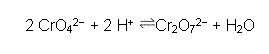
En esta reacción el oxoanion monomérico actuaría como base y el condensado como ácido conjugado, de esa manera esta reacción sería como de ácido-base.
Puede ocurrir más de una condensación, como ocurre con el ion adenosina fosfato, que se transforma en adenosina bi fosfato o adenosina tri-fosfato (ATP), molécula de gran importancia biológica, dado que su hidrólisis aporta mucha energía al metabolismo celular.
