Conceptos de Disolución de Sustancias
La disolución es un fenómeno importante en el cual una o más sustancias, los solutos se mezclan de forma homogénea con otra sustancia, el solvente.
Más allá que existen soluciones sólidas, las soluciones más comunes involucran un solvente líquido. Todos los días disolvemos sustancias en agua, por ejemplo, tal como la sal de cocina y el azúcar.
Para cada conjunto de condiciones existe una cantidad límite de una dada sustancia que se consigue disolver en un determinado solvente y que se designa como solubilidad de esa sustancia en ese solvente.
Por ejemplo disolver a temperatura ambiente de 25ºC, se logran disolver cerca de 36 gramos de cloruro de sodio en 100 ml de agua, siendo por tanto de 36 g/100 ml la solubilidad del cloruro de sodio en agua.
Si adicionamos más sólido a la solución este no se va a disolver, permaneciendo el soluto disuelto en equilibrio con el respectivo sólido que está en contacto con la solución.
Teniendo en cuanta la cantidad de soluto disuelto en un determinado solvente y la solubilidad de este, las soluciones se pueden presentar como:
- Insaturadas, cuando la cantidad de soluto en la solución es inferior a su solubilidad
- Saturadas, si la cantidad de soluto en solución fuese igual a la solubilidad de este soluto
- Sobresaturadas, soluciones en que la concentración del soluto en solución es superior a su solubilidad
Cuando un soluto se disuelve en un solvente, las moléculas del solvente forman estructuras en torno de las moléculas del soluto, en un proceso denominado solvatación.
En el caso de sustancias iónicas que se disuelven en solventes como el agua, el proceso de disolución implica la separación de los respectivos iones constituyentes, los cuales serán solvatados por el agua.
En estos casos, el equilibrio que se establece entre el sólido y el compuesto disuelto depende de las concentraciones en solución de todos los iones que constituyen la sal.
Para el caso del sulfato de aluminio sólido (Al2(SO4)3) en contacto con una solución saturada de sulfato de aluminio (Al2(SO4)3 (disociado en iones Al3+ e SO42-), el equilibrio se traduce por:
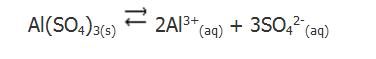
La constante que se asocia a este equilibrio se denomina producto de solubilidad (Kps) y es expresada, en el caso de esta sal, por el producto de las concentraciones molares de equilibrio de los iones cada cual elevada a sus respectivos coeficientes estequiométricos.
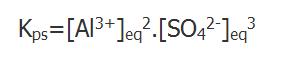
Cuando se mezclan dos soluciones pueden o no formarse precipitados. De forma de prever la formación o no de estos, se recurre al cálculo de un cociente denominado Cociente de Reacción, que involucra el producto de las concentraciones de iones involucrados elevados a los respectivos coeficientes estequiométricos, de forma semejante a la que se utiliza para calcular el Producto de Solubilidad (notemos que el producto de solubilidad corresponde al cociente de reacción cuando la solución está saturada, o sea, cuando las concentraciones de los iones corresponden a sus concentraciones de equilibrio); se compara el valor de Q con el de Kps.
Así pueden ocurrir tres casos diferentes:
- Se Q<Kps la solución no está saturada, entonces no habrá precipitación
- Se Q=Kps la solución está saturada, no existiendo precipitación
- Se Q>Kps la solución está sobresaturada y existe precipitación
Para la determinación del valor de Q es necesario tener en cuenta que al juntar dos soluciones, el volumen disponible para cada electrolito se altera. Siendo así es necesario calcular las nuevas concentraciones de los iones intervinientes. Normalmente para este cálculo, se considera que los volúmenes son aditivos.
Otro factor a tener en cuenta es la temperatura a la que las soluciones se encuentran, si esta no fuese conocida se considera que ambas soluciones estaban, inicialmente a la misma temperatura y que la misma se mantiene luego de la mezcla.
