Saturación
Es posible establecer una relación entre las cantidades de soluto disuelto en determinada cantidad de solvente en una temperatura dada. Por ejemplo, imagine que 10 g de sal fueron mezclados en 100 ml de agua a 20ºC. Veremos que la sal se disuelve completamente y podemos hasta inclusive colocar más sal que se continuará disolviendo.
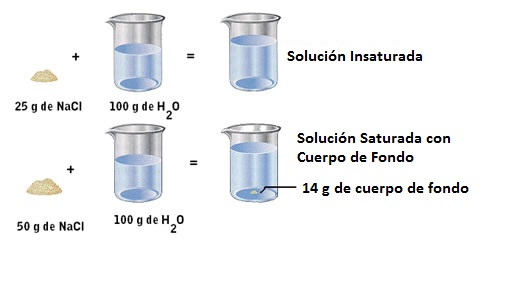
Si colocamos 25 g de sal en la misma cantidad de agua, a la misma temperatura, la sal también se disolverá del todo. Sin embargo, si colocamos 50 g de sal en 100 ml de agua a 20ºC, 14 g de sal no se solubilizarán, permaneciendo en el fondo del recipiente. Esta parte que no se disuelve, se le llama el precipitado, cuerpo de la planta o el cuerpo del fondo.
Por medio del último ejemplo vemos que existe una cantidad límite o cantidad máxima de soluto que se disolverá en determinada cantidad de solvente que llamamos como coeficiente de solubilidad. En el caso de la sal, el coeficiente de solubilidad es de 36 g en 100 ml o 100 g de agua a 20 ºC y por ello que de 50 g, 14 gramos no se solubilizarán.
El coeficiente de solubilidad varía de acuerdo con el soluto, la cantidad de solvente y la temperatura en la que se encuentra la solución. En cuanto a la naturaleza del soluto, substancias diferentes se disuelven en cantidades diferentes, en una misma cantidad de solvente a la misma temperatura.
Si disolvemos 100 g de azúcar, que es bastante más que la cantidad de sal disuelta en 100 ml de agua, a 20º C, todo el azúcar se disolverá lo cual significa que su coeficiente de solubilidad es bastante mayor que el de la sal.
Cuando colocamos una cantidad de soluto por debajo de su coeficiente de solubilidad, tenemos una solución insaturada o no saturada.
En cambio, si colocamos exactamente el coeficiente de solubilidad (36g), tendremos una solución saturada, esto quiere decir, solución que contiene la máxima cantidad de soluto en una cantidad de solvente a una determinada temperatura
En el ejemplo que dimos en que se colocaron 50g de sal y 14 g no se disolvieron, tenemos una solución saturada con cuerpo de fondo. Para obtener solamente la solución saturada se necesita solamente realizar una filtración.
Ahora si calentamos esta solución saturada con cuerpo en el fondo, el precipitado se irá a disolver totalmente, pues a una temperatura más elevada, su coeficiente de solubilidad aumenta. Si dejamos esa solución en reposo, hasta volver a la temperatura de 20ºC, obtendremos una solución supersaturada, que es muy inestable, pues contiene más soluto disuelto de lo que es su coeficiente de solubilidad en esa temperatura.
Entonces si adicionamos a ella un pequeño cristal de soluto, sucederá la precipitación de los 14 g de sal, que es la cantidad disuelta por encima de la cantidad posible para la saturación (36 g).
Por ejemplo, al adicionar un pequeño cristal a una solución supersaturada de acetato de sodio, la cristalización se inicia, haciendo que todo el exceso se cristalice. Esto puede ser apreciado en la figura a continuación: