Equilibrio de Solubilidad
Todos nosotros diariamente tenemos contacto con productos que se disuelven fácilmente en agua (como por ejemplo la sal y el azúcar) y con otros que se pueden considerar insolubles en esta (tales como lípidos – el aceite por ejemplo)
Esta capacidad de las sustancias disolverse o no, en un solvente dado es cuantificada a través de la solubilidad (cantidad máxima de soluto que es posible de disolver en determinada cantidad de solvente)
La Solubilidad
La solubilidad de una dada sustancia en un solvente puede ser afectada por determinados factores. Entre los más importantes se pueden destacar:
- La dependencia de la temperatura
- El efecto de ión común
- El Ph de la solución
- Los equilibrios de complexación
Dependencia do Kps con a temperatura
Dependiendo del tipo de reacciones que ocurren cuando de la mezcla de soluciones, el Kps puede aumentar o disminuir. Así, pueden ocurrir dos casos diferentes.
- Reacción endotérmica: En el caso de reacciones endotérmicas el Kps aumenta con el aumento de la temperatura indicando, también un aumento de la solubilidad.
- Reacción exotérmica: en el caso de reacciones exotérmicas el Kps disminuye con el aumento de la temperatura, disminuyendo también la solubilidad.
El efecto del ión común
Si se analiza la ecuación de equilibrio de disociación para, por ejemplo el sulfato de aluminio (indicado debajo), aplicando el principio de Le Chatelier, se verifica que al aumentar la concentración de uno de los iones, por ejemplo, el ión sulfato, el equilibrio se trasladará en el sentido de formación del sulfato de aluminio sólido, disminuyendo por tanto la solubilidad de esta sal.
Este efecto es conocido como efecto del ión común
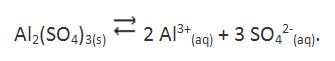
De esta forma se justifica el hecho de que cuando se adiciona sulfato de sodio (Na2SO4) a una solución saturada de sulfato de aluminio (Al2(SO4)3), aumentando así la concentración del ión SO42-, una parte del sulfato de aluminio en solución precipitará.
Influencia del pH de la solución en la solubilidad
En un equilibrio de disolución en que entran iones OH–, tal como el equilibrio de disolución del hidróxido de aluminio, por ejemplo, el pH de la solución va a afectar la solubilidad del sólido.
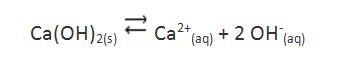
Por el principio de Le Chatelier, se verifica que al aumentar la concentración de iones OH– (aumentando el pH) en la solución, el equilibrio se traslada en el sentido de la formación de Ca(OH)2 sólido, reduciendo entonces la solubilidad de este.
Por otra parte, al aumentar la concentración de iones H+ (disminuyendo el pH) vamos a reducir la concentración de iones OH– en solución, por lo que la solubilidad aumenta.
Influencia de los equilibrios de complexación en la solubilidad
La solubilidad de un determinado compuesto depende, también, de su capacidad para formar iones complejos.
Por ejemplo si consideramos el hidróxido de zinc (Zn(OH)2), este, en agua pura presenta un producto de solubilidad bajo(Kps= 1,9×10-17, a 25ºC).
Sin embargo, si existe un exceso de hidróxido, la solubilidad del hidróxido de zinc es bastante mayor, desde que existe formación de un ión complejo.
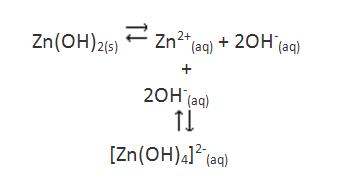
La constante de equilibrio asociada a un equilibrio de complexación se denomina Constante de Formación del complejo y se denomina como Kf.
