Tipos de soluciones
Dependiendo de la cantidad de soluto que una solución contiene, podemos clasificar las soluciones. Tengan en cuenta que para la cantidad de soluto que puede ser añadida a un determinado volumen de solvente y que llamamos de coeficiente de solubilidad.
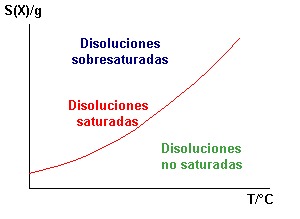
Cuando una solución contiene soluto abajo del coeficiente de solubilidad, decimos que esa solución es insaturada. Cuando la cantidad de soluto es igual al coeficiente de solubilidad, o sea, está en el límite, decimos que es saturada. Finalmente, cuando la cantidad de soluto supera el limite, décimos que es sobresaturada.
Usted se debe estar preguntando: ¿cómo es posible tener una cantidad de soluto superior al límite? ¿Al final es el límite o no? Las soluciones dichas sobresaturadas, que contienen una cantidad de soluto superior al coeficiente de solubilidad son extremadamente difíciles de preparar y muy instables.
Imagine la siguiente situación: usted quiere apilar latas de refresco y lo máximo que logra apilar son cuatro latas. Intentó hacerlo miles de veces y el límite es cuatro latas. De repente, usted utiliza toda su concentración y cuidado dignos de un monje budista y logra apilar la quinta lata. En ese momento alguien golpea la puerta de su laboratorio y la quinta lata cae, quedando solamente cuatro apiladas. Usted vuelve a concentrarse y logra apilar, ¡no cinco, sino seis latas! En ese momento se aproxima de su pila un mosquito y posa sobre ella, derribando dos latas, resultando nuevamente cuatro latas apiladas.
Es exactamente eso lo que sucede en las soluciones sobresaturadas. En condiciones especiales logramos disolver una cantidad de soluto superior al coeficiente de solubilidad (CS) pero, en la primera perturbación el excedente se precipita restando disuelta apenas a cantidad límite, lo que convierte la solución en saturada.
Curva de solubilidad
La solubilidad varía de soluto para soluto y también con el tipo de solvente. Además el principal factor que influencia en la solubilidad es la temperatura. El coeficiente de solubilidad varía con la temperatura, pudiendo aumentar o disminuir con el ascenso de temperatura, dependiendo del soluto en cuestión. La variación del coeficiente de solubilidad de acuerdo a la temperatura es representada en un gráfico que llamamos de curva de solubilidad.
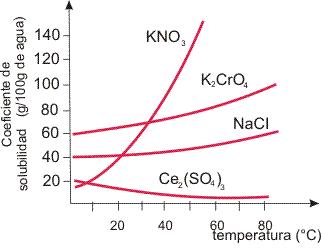
En la curva de solubilidad podemos identificar todavía:
Como alterar la concentración?
Si Usted prepara una solución cualquiera, su concentración no se altera si, por ejemplo, la divide en dos frascos. Si fuese verdad y hubiésemos endulzado demasiado una taza de café, bastaría con dividir el contenido en dos tazas y el café quedaría menos dulce.
Para alterar la concentración de una solución, podemos:
- Aumentar la cantidad de soluto, aumentando la concentración;
- Aumentar la cantidad de solvente, disminuyendo la concentración;
- Disminuir la cantidad de solvente, aumentando la concentración.
¿Le sorprendió el tercer método? ¿Cómo podemos disminuir la cantidad de solvente? Evaporarlo puede ser un excelente método. Coloque una cuchara de té de sal de en un vaso con agua. Usted verá que toda la sal se disuelve. Coloque esa solución en una olla y lleve al fuego. Verá que, a la medida en que el agua (solvente) se evapora, la solución se hace más concentrada, hasta resultar en saturada y luego comienza a precipitar sal, indicando que la concentración está por encima del límite. Ya debe haber estudiado o presenciado ese procedimiento en laboratorio, muy conocido como destilación simples y utilizado para separar los componentes de una solución.
