Pirometalurgia
La pirometalurgia es la rama de la metalurgia que se encarga de la obtención y purificación de los metales, a través de la utilización del calor. Es la técnica más tradicional de extracción de metales, a partir de los minerales, eliminando la ganga, que se trata de silicatos u otros minerales sin interés, que se desechan para obtener el metal a partir del mineral.
Este método de obtención fue el primero en ser utilizado. Metales como el hierro, níquel, cobre, oro, etc., se obtienen desde el mineral gracias a esta técnica, que es utilizada en gran proporción debido a ser un proceso muy rápido en comparación con otros, pero tiene la desventaja de ser bastante contaminante para el medio ambiente.
En pirometalurgia, una vez se consigue eliminar la ganga, o al menos su mayor parte, empieza el proceso de obtención del metal. Dicho proceso consiste básicamente en una reducción química, pues es preciso convertir el metal desde su número de oxidación positivo (con el que aparece en el mineral en estado libre), a número de oxidación cero:
M^n+ + ne^- → M
Dicha reducción puede llevarse a cabo de dos formas distintas:
- Pirometalurgica o por vía térmica, incluye varios procesos como la calcinación, tostación y reducción. Todos los procesos de esta vía se producen a altas temperaturas, producidas por la quema de diversos combustibles. La mayorñia de los metales se obtienen de ésta forma.
- Electrólisis de sales o de óxidos de metales reductores, como pueden ser los metales alcalinos, alcalinotérreos o también con el aluminio.
Calcinación:
La calcinación consiste en el calentamiento de minerales que son formados por hidróxidos, a una temperatura muy elevada, con el fin de descomponer el mineral eliminando en forma de gas el agua o también el dióxido de carbono. De este modo se obtiene el óxido del metal, por ejemplo:
2 Fe(OH)3 (s) → Fe2O3 (s) + 3 H2O (g)
ZnCO3 (s) → ZnO ( s) + CO2 (g)
Tostación:
Es un proceso al cual se somete a los sulfuros metálicos, consiste en el calentamiento del mineral con la presencia del oxígeno (del aire), lo que lleva a la formación del óxido del metal y de dióxido de azufre en estado gaseoso. Dicho gas puede ser usado con posterioridad para la fabricación del ácido sulfúrico, evitando así la contaminación del medio ambiente, ya que es uno de los gases causantes de la lluvia ácida.
La tostación se realiza en hornos de tostación, los cuales tienen diferentes formas.
La tostación de sulfuros de cinc y de plomo, se produce a través de las siguientes reacciones:
2 ZnS (s) + 3 O2 (g) → 2 ZnO (s) + 2 SO2 (g)
2PbS (s) + 3 O2 (g) → 2 PbO (s) + 2 SO2 (g)
El mercurio se obtiene directamente en forma de vapor a partir del sulfuro, condensandose dicho vapour y pasando a estado líquido:
HgS ( s) + O2 (g) → SO2 ( g) + Hg ( g)
Existen muchos tipos diferentes de tostaciones como la tostación oxidante, magnetizante, sulfatante, clorurante, carbonizante, segregante, volatilizante, reductora, etc.
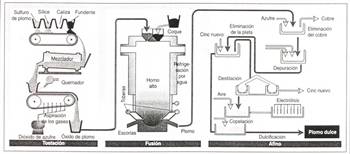
Reducción:
Este proceso consiste en la obtención del metal libre a raíz del óxido metálico en el cual el metal aparece con oxidación positiva.
Para su realización se usa un reductor, que en muchos casos es el carbón, el CO, el hidrógeno, o cualquier otro metal más reductor.
Al igual que la calcinación, este proceso se lleva a cabo en hornos de diferentes formas y tamaños.
Existen metales que en la naturaleza ya se encuentran en forma de óxidos, en cambio otros, aparecen como sulfuros, y deben ser tostados previamente para convertirlos en óxidos. En el caso de que se presenten a modo de carbonatos, previamente se necesita una calcinación:
SnO2 (s) + 2C (s) → Sn (l) + 2 CO (g)
Cr2 O3 (s) + 2 Al (s) → 2 Cr (l) + Al2 O3 (s)
Los procesos pirometalúrgicos tienen ventajas y desventajas:
Ventajas:
- Poseen una rápida velocidad de reacción
- Obtienen una producción elevada
- Son ideales para tratar materias primas heterogéneas y complejas
Desventajas:
- Tienen poca selectividad
- A menudo se deben repetir las etapas de obtención
- Produce gran contaminación ambiental debido a los residuos gaseosos como el SO2.
- Consume una elevada cantidad de energía.
