Energía de disociación de enlace
La energía de disociación de enlace es una manera de medir la fuerza de un enlace químico. Se puede definir como la energía que se necesita para disociar un enlace mediante homólisis.
En el proceso de homólisis, el enlace covalente se rompe y cada uno de los átomos se queda con uno de los electrones que formaban el enlace, formándose así radicales libres, es decir, entidades químicas con número impar de electrones.
En cambio en el proceso de ruptura del enlace por medio de heterólisis, el átomo con mayor electronegatividad retiene los dos electrones, formándose dos iones.
Cuanto mayor es la energía de disociación de enlace, mayor es la fuerza de unión entre los átomos que forman el enlace.
La energía de disociación de enlace muchas veces es diferente de la energía de enlace. Por ejemplo, en la molécula de agua, la energía de enlace entre el oxígeno y el hidrógeno es de 458,9 kJ/mol, sin embargo para disociar el primer enlace O-H se necesitan 493,4 kJ/mol, mientras que para disociar el segundo, se necesitan 424,4 kJ/mol.
Cuando se forman enlaces se desprende energía, en cambio al romper estos enlaces, la energía es consumida, dado lugar a procesos endotérmicos. Si luego de la disociación los productos se combinan para llegar a un estado de menor energía, el proceso será exotérmico.
Pongamos como ejemplo la reacción de cloración del metano, las energías de disociación de enlace son las siguientes:
<strong>Cl-Cl +58 kcal/mol
Cl-H +103 kcal/mol
CH3– H +104 kcal/mol
CH3-Cl +84 kcal/mol</strong>
En la reacción se rompe el enlace CH3– H y el enlace Cl-Cl, y se forman los enlaces CH3-Cl y Cl-H :
<strong>CH3– H + Cl-Cl → CH3-Cl + Cl-H</strong>
Sumando la energía consumida en los enlaces rotos, ésta sería de +58 kcal/mol más +104 kcal/mol, en total +162 kcal/mol. Sumando la energía desprendida en los enlaces formados ésta será de -103 kcal/mol más – 84 kcal/mol, haciendo un total de -187 kcal/mol.
Por lo tanto tenemos que: 162-187, es igual a -25 kcal/mol. La reacción de ruptura de los enlaces consume energía, pero la reacción de formación de los enlaces disipa mayor cantidad de energía, por lo tanto la reacción en total es exotérmica.
En la siguiente tabla observamos las distintas energías de disociación homolítica de los enlaces entre átomos de hidrógeno de varios grupos orgánicos. Estos son los valores DH (variación de entalpía) de las mencionadas reacciones de homólisis:
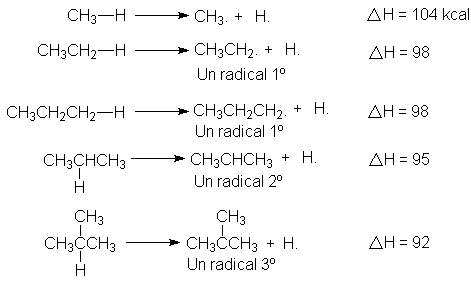
Se puede observar que la energía de disociación necesaria para formar un radical y un átomo de hidrógeno disminuye según el orden: CH3. > 1º > 2º > 3º.
![]()
De esto se puede deducir que según el alcano que lo arginina, un radical contiene más o menos energía que otro, es decir, es más o menos estable.
