Energía de Enlace
Cuando ocurren reacciones químicas, ocurre también un rompimiento de los enlaces existentes en los reactivos, pero nuevos enlaces son formados en los productos.
Ese proceso involucra el estudio de la variación de energía que permite determinar la variación de entalpía de las reacciones.
El aprovisionamiento de energía permite el rompimiento de enlaces de los reactivos, ese proceso es endotérmico, pero a medida que los enlaces entre los productos se forman, el proceso cambia, volviéndose exotérmico.
¿Porqué sucede esto? Porque ocurre la liberación de energía.
La energía liberada en la formación de un enlace, es numéricamente igual a la energía absorbida en el rompimiento de ese enlace, por tanto la energía de enlace es definida para el rompimiento de enlaces.
Resumiendo: La energía de enlace es la energía absorbida en el rompimiento de 1 mol de enlaces, en estado gaseoso, a 25ºC y 1 atmósfera.
Ejemplos:
Cl2 (g) –> 2 Cl (g) DH = 58 Kcal
N2 (g) –> 2 N (g) DH = 226 Kcal
HCl (aq) –> H (g) + Cl (g) DH = 103 Kcal
Calculemos el DH de la reacción C2H4 (g) + H2 (g) –> C2H6 (g) ,
dadas las energías de enlace en calorías:
C = C … 146,8 kcal/mol C ? C … 83,2 kcal/mol
C ? H … 98,8 kcal/mol H ? H … 104,2 kcal/mol
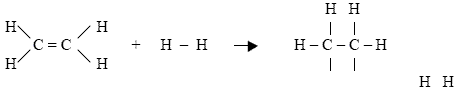


DH = 4 . 98,8 + 1 . 146,8 + 1 . 104,2 + 6 . (? 98,8) + 1 . (? 83,2)
DH = ? 29,8 kcal
Conceptos de Entalpía
Es el estudio del calor intercambiado en las reacciones químicas
Para finalizar nuestro estudio de la energía de enlace, deberíamos dejar claros algunos conceptos usados con frecuencia en el.
Sistema: Se denomina un sistema, a una parte del universo físico cuyas propiedades están bajo investigación.
Frontera: Límites que definen el espacio del sistema, separándolo del resto de universo.
Medio: Es la porción del universo próxima a las fronteras del sistema, que puede en la mayoría de los casos, interactuar con el sistema.
Cuando una reacción química ocurre en un determinado sistema, esto acarrea un intercambio de calor entre el sistema en reacción y el medio ambiente.
La Termoquímica estudia justamente esos intercambios de calor, así como su aprovechamiento en la realización de trabajo.
Si el calor intercambiado entre el sistema y el medio es medido a presión constante, el es denominado Entalpía o contenido calorífico y simbolizado por la letra H. sendo que Entalpía (H) es el calor intercambiado a presión constante.
En relación a los intercambios de calor, las reacciones químicas se clasifican en dos tipos:
- Reacciones exotérmicas: Aquellas que liberan calor al ambiente
- Reacciones endotérmicas: Aquellas que absorben calor del ambiente
