Antocianinas
Las antocianinas son pigmentos responsables por una variedad de colores atractivos y brillantes de frutas, flores y hojas que varían desde el rojo vivo al violeta o azul. Son obtenidas fácilmente por extracción a frío con metanol o etanol débilmente acidificado.
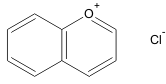
Antocianina
Algunas antocianinas son lábiles y se descomponen en presencia de ácidos minerales y en este caso, la extracción debe ser realizada con solventes acidificados con ácido acético.
Son siempre encontradas en la forma de glucósidos fácilmente hidrolizados por calentamiento con HCl 2N, en azúcares y agliconas, denominadas antocianidas. Las antocianidas tienen como estructura básica el catión 2- fenilbenzopirilium, también denominado flavilio.
Las antocianinas son anfóteras y a pH bajos, cuando colocadas en campo eléctrico deberían migrar hacia el cátodo. En diferentes pH estos pigmentos se encuentran en diferentes formas y presentan colores diversos.
En medio ácido las antocianinas se encuentran en la forma de sales de ozono y son generalmente de color rojo brillante. Con el aumento del pH de las soluciones, las antocianinas pasan a tener una estructura quinodial, púrpura y en medios alcalinos el color cambia al azul.
Las antocianinas están presentes en numerosas especies de plantas, algunas de las cuales ya fueron experimentadas como fuente industrial en potencia.
Comportamiento de pigmentos vegetales en relación al pH de las soluciones.
El color de los pigmentos vegetales está asociado a su estructura química y su coloración en medio ácido o básico dependerá justamente de las modificaciones sucedidas en la molécula del pigmento, cuando el mismo es sometido a diferentes valores de pH.
Clorofilas, flavonoides y betalainas son compuestos sensibles a cambios de pH de las soluciones. En las clorofilas el color en medio ácido pasa a verde oliva y en medio básico-alcalino a verde brillante.
Las antocianinas tienen color rojo intenso en valores de pH bajos. A medida que el pH aumenta la coloración pasa a ser más violeta.
Extraído con agua o soluciones alcohólicas, el extracto de la cáscara de uva contiene 25 pigmentos diferentes, dependiendo de la variedad. El colorante es frecuentemente denominado enocianina y su principal cromóforo presente en la cáscara de uva es la mezcla compleja de antocianinas: antocianidina (aglicona), azúcar y frecuentemente ácidos.
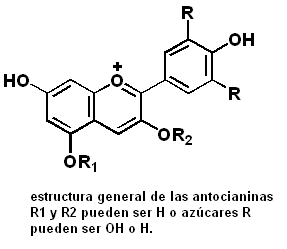
En la naturaleza las antocianinas siempre se aprecian en la forma heteroglucosídica, conteniendo una o más moléculas de azúcar y de la aglicona antocianidina. Son solubles en agua y en mezcla de agua y alcohol, sin embargo, son insolubles en aceites y grasas.
Diferentes monosacáridos (glucosa, galactosa, remanosa, arabinosa), disacáridos y trisacáridos también pueden ser encontrados.
En algunos casos el azúcar se acila con los ácidos ferrúlico, cafeico y p-cumárico.
La presencia del grupo glucosídico en la posición 3 confiere mayor estabilidad, siendo la forma diglucosídica más estable al calentamiento y la luz que la monoglucosídica y la presencia del grupo hidroxilo en la posición 3 aumenta la sensibilidad del compuesto a la degradación.
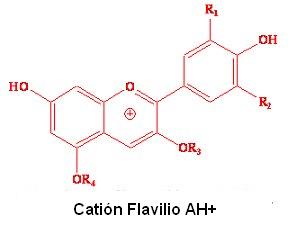
El núcleo flavilio de la antocianina es deficiente en electrones y por tanto, altamente reactivo. Su reacción generalmente involucra decoloración del pigmento, siendo por tanto, indeseable en el procesamiento de frutas y vegetales.
Colorantes comerciales derivados de uvas han presentado un considerable éxito en bebidas, pero todas las antocianinas convencionales presentan algún tipo de limitación.
La estabilidad es un problema ya que las antocianinas son degradadas en la presencia de metales, ácido ascórbico, azúcar, oxígeno, temperatura y enzimas.
La inestabilidad al pH es un factor limitante en varias situaciones, afectando el color y la estabilidad química, decolorando en valores de pH por encima de 4,0. En soluciones ácidas la antocianina es roja, pero con el aumento del pH la intensidad del color disminuye.
En solución alcalina, el color azul es obtenido, siendo sin embargo, inestable. Para aplicaciones generales, el pH entre 1,0 y 3,5 confiere una mayor estabilidad.
Las antocianinas son utilizadas en bebidas ácidas, jaleas, dulces y cosméticos. La adición de ácido ascórbico para el efecto de estabilización no es recomendada y la presencia de azúcares, especialmente la fructuosa, acelera el proceso de oscurecimiento.
Además del pH (principal responsable por la estabilidad de las antocianinas), otros factores contribuyen para su degradación.
Sulfito: El dióxido de azufre, utilizado en la prevención del oscurecimiento y crecimiento microbiológico, promueve la decoloración de la antocianina, por su adición en la posición 2 o 4.
Metales: Las antocianinas que posean sistema 0-düdroxilado (anillo B), se vuelven complejas con metales alterando su coloración. Estos complejos son más estables a los efectos del pH y de la luz que los compuestos similares.
