Propiedades Coligativas de las Soluciones
Presión de Vapor
Presión de vapor de un líquido A a una determinada temperatura es la presión del vapor de A en el equilibrio líquido (A) <==> vapor (A), en esa temperatura.
La presión de vapor aumenta con la temperatura.
Vaporizando un líquido en el interior de una cámara barométrica del tipo Torricelli, hasta ser alcanzado el equilibrio líquido <==> vapor, el descenso de la columna de mercurio mide la presión de vapor a temperatura de la experiencia.
Cuanto mayor es la presión de vapor a una misma temperatura, más volátil es el líquido.
Presión de vapor y cambio de estado
Un líquido entra en ebullición a temperatura en que su presión de vapor se iguala a la presión exterior. Así, a 100ºC el agua tiene presión de vapor igual a 1 atm.
La mayoría de los sólidos se funde con expansión de volumen. El hielo es una de las pocas excepciones fundiéndose con contracción de volumen.
El Punto de fusión del hielo aumenta con la disminución de la presión y viceversa. Para la mayoría de los sólidos el Pf aumenta con el aumento de presión y viceversa.
El Punto de Ebullición de todas las sustancias aumenta con el aumento de la presión y viceversa.
Las variaciones de los Pf son insignificantes con la variación de la presión, porque en el equilibrio sólido <==> líquido no existe participante gaseoso.
Las variaciones de los Pe son significativas con la variación de presión, porque en equilibrio líquido <==> vapor existe participante gaseoso.
Punto Triple
Punto triple de una sustancia es un estado en el cual se establece el equilibrio sólido <==> líquido <==> vapor. Solamente a una determinada temperatura y presión que varía de una sustancia a otra, se establece ese equilibrio triple.
En el caso del agua, ese equilibrio se establece solamente a 0,01ºC y 4,58 mmHg.
No existe líquido a una presión inferior a la del respectivo punto triple. Así, no existe agua líquida a una presión menor que 4,58 mmHg.
A una presión inferior a la del unto triple, ocurre solamente el equilibrio sólido <==> vapor (Sublimación)
Sustancia que sublima a presión ambiente tiene la presión del punto triple por encima de la presión ambiente (1 atm. A nivel del mar) por ejemplo el hielo seco o CO2 (s)
Tonoscopía
Δp = p2 – p
| Medida | Símbolo |
| Presión del Vapor de la Solución | p |
| Presión del Vapor del Solvente | p2 |
| Fracción molar del soluto | X1 |
| Fracción molar del solvente | X2 |
| Constante tonoscópica molar | Kt |
| Masa molar del solvente | M2 |
| Molaridad de la solución | W |
| Concentración de la solución en mol/litro | [soluto] |
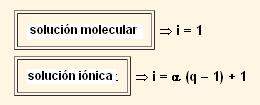
| Grado de disociación iónica | α |
| Número de iones/molécula | q |
| Factor de Van’t Hoff | i |
Crioscopía
Δtc = Tc2 – Tc
| Medida | Símbolo |
| Temperatura de congelado de la solución | Tc |
| Temperatura de congelación del solvente | Tc2 |
| Constante Crioscópica | Kc |
| Calor de fusión del solvente (Cal/kg) | Lc |
Ebulloscopia
Δte = Te2 – Te
| Medida | Símbolo |
| Temperatura de ebullición de la solución | Te |
| Temperatura de ebullición del solvente | Te2 |
| Constante de ebullición del solvente (cal/g) | Le |
En todas las expresiones donde aparece i (factor de van’r Hoff):
Osmosis
| Medida | Símbolo |
| Presión Osmótica | P |
| Temperatura de la Solución | T |
Constante universal para un gas ideal
p = [soluto] · R · T · i