Teoría de las Soluciones y la Solubilidad
Cuando dos o más sustancias son mezcladas, diversas situaciones son posibles:
a) Las fuerzas de interacción de los componentes puros son alteradas, apareciendo un nuevo balance de fuerzas que incluye interacciones entre todos los componentes. En este caso, el sistema adquiere una distribución homogénea de todos los compuestos que lo forman. Esta mezcla se denomina entonces mezcla homogénea, poseyendo una única fase.
b) Los componentes de la mezcla mantienen las fuerzas de interacción que poseían cuando estaban puros, no ocurriendo interacción entre los diversos componentes a nivel molecular. En este caso el sistema posee heterogeneidad en su composición.
Esta mezcla es denominada entonces de mezcla heterogénea y posee diversas fases.
c) Finalmente existen sistemas intermedios entre el homogéneo y heterogéneo: los coloides. Los coloides ocurren cuando existe una fase de dimensiones muy pequeñas (las cuales no pueden ser vistas a simple vista) dispersa uniformemente sobre otra de forma estable.
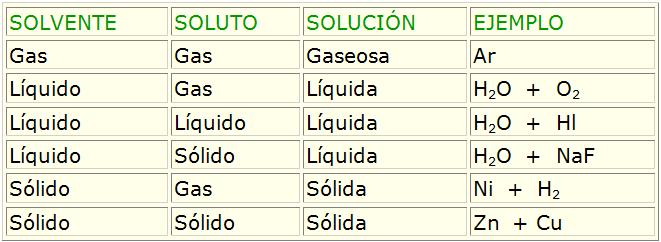
Las mezclas homogéneas son también conocidas como soluciones. En estos sistemas, uno o más componentes (soluto) son disueltos en otro que posee mayor cantidad (solvente). La cantidad máxima posible de un soluto en la solución es definida como la solubilidad del solvente. Tanto el solvente cuanto el/los soluto/s pueden presentarse en los tres estados físicos, siendo que la solución generalmente permanece en estado del solvente. Por tanto pueden ser verificadas soluciones gaseosas, líquidas o sólidas. En la tabla a continuación, las diversas situaciones posibles para una solución son presentadas.
En la Teoría cinética de los gases fue definido que los gases se mezclan de forma homogénea en cualquier proporción. O sea, independientemente de la naturaleza de los gases involucrados, ellos van a disolverse siempre, no importando las cantidades involucradas.
Ya, para soluciones sólidas o líquidas, esta situación no siempre se verifica. La solubidad de un determinado soluto en un solvente, depende esencialmente de la naturaleza de ambos, esto porque es necesario que existía afinidad para realizar interacciones entre ellos.
En otras palabras, un determinado compuesto puede o no ser soluble en otro. Por otra parte la naturaleza de las especies involucradas también determina donde la solubilidad es alcanzada. Para algunos casos, como la disolución del etanol en agua, no existe límite de solubilidad en la proporción entre ellos.
Sin embargo en otros casos, como la disolución de cloruro de sodio en agua, existe un límite de solubilidad, a partir del cual la sal no se solubiliza más. Se puede entonces clasificar las solubilidades de un soluto en tres clases: insoluble, soluble en cualquier proporciones y parcialmente soluble. En el cuadro debajo están relacionados algunos compuestos con su solubilidad en diversos solventes.
| Soluto | Agua | Etanol | Benceno |
| Etanol | ∞ | — | s |
| Naftaleno | i | s | s |
| Ácido Acético | ∞ | ∞ | ∞ |
| Leyenda : ∞ – Soluble infinitamente s – Poco soluble i -Insoluble | |||
Dependiendo de la cantidad de soluto presente en una solución, esta es clasificada como diluida (para pequeñas cantidades) o concentrada (para altas cantidades). Es importante notar que esta clasificación es arbitraria, no existiendo una definición clara de estas cantidades.
En el caso de soluciones donde el soluto es parcialmente soluble, aparece aún otra clasificación. Cuando el límite de solubilidad es alcanzado y la adición de más soluto en la mezcla no altera la cantidad de soluto en solución (disuelto), esta es dicha como saturada. Por analogía, antes del límite ser alcanzado, la solución es llamada como insaturada.