Teoría del Estado de Transición o Complejo Activado
La Teoría del complejo activado, o Estado de Transición perfecciona la teoría de las colisiones al indicar un modo de calcular la constante de velocidad a pesar de las exigencias estéricas sean significativas. La teoría del complejo activado, o teoría del estado de transición fue desarrollada por Eyring e Polanyi (1935). Ella toma en consideración la naturaleza de las moléculas, se basa en cálculos que tienen origen en la termodinámica estadística y en la mecánica cuántica y puede ser aplicada para reacciones en fase gaseosa o en solución.
La teoría del complejo activado es un intento de identificar los aspectos principales que gobiernan el valor de una constante de velocidad en términos de un modelo de eventos que ocurren durante la reacción. Se puede comprender el concepto del complejo activado a partir de la observación de aspecto general de la variación de energía potencial de los reactivos A y B durante el avance de una reacción elemental bimolecular, como se puede ver ilustrado en el gráfico a continuación:
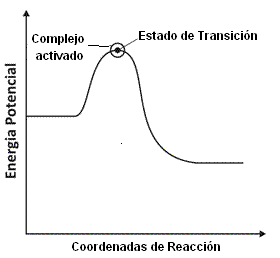
En principio, solamente A y B entran en contacto, se deforman, intercambian átomos o los rechazan. La energía potencial alcanza un máximo y la aglomeración de átomos que corresponde a la región vecina al máximo y es el complejo activado.
Luego, el máximo de energía potencial disminuye a medida que los átomos se organizan y alcanzan la configuración de los productos. En el punto máximo de la curva de energía potencial las moléculas de los reactivos alcanzarán un punto de aproximación y de deformación tan grande que una pequeña deformación extra hace que el sistema avance hacia los productos.
La configuración crítica de los átomos es el estado de transición de la reacción. A pesar de algunas moléculas en estado de transición retornasen a la condición inicial de los reactivos, muchas superan la configuración de aquel estado y entonces es inevitable la formación de los productos después del encuentro.
Para esta teoría, en una primer etapa reversible los reactivos entran en equilibrio con un complejo activado y este entonces es que se descompone dando origen a los productos de la reacción.
Como ejemplo: según esta teoría, una reacción bimolecular, ocurre de acuerdo con el mecanismo:
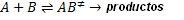
Donde 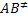 representa el complejo activado formado por las moléculas reactivas. Llamando de
representa el complejo activado formado por las moléculas reactivas. Llamando de 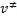 a la frecuencia de vibración según la cual el complejo activado se descompone, la velocidad de formación de los productos será dada por:
a la frecuencia de vibración según la cual el complejo activado se descompone, la velocidad de formación de los productos será dada por:
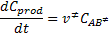
La etapa de formación del complejo activado tiene la siguiente constante de equilibrio:
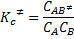
Siendo la concentración del complejo activado igual a:
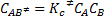
De acuerdo con el principio de la equipartición de energía, a cada grado de libertad transicional, vibracional o rotacional debe ser asociado el valor de energía kT, donde k es la constante de Boltzmann y T la temperatura y esta energía es igual a 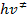 , siendo h la constante de Planck. Podemos escribir entonces:
, siendo h la constante de Planck. Podemos escribir entonces:
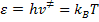
Aislando 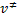 tenemos la frecuencia de descomposición del complejo activado:
tenemos la frecuencia de descomposición del complejo activado:
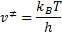
Sustituyendo los valores de 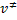 y
y 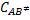 en la ecuación,
en la ecuación,
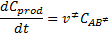
Encontramos:
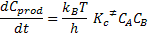
Comparándose esta ecuación con la ecuación cinética que provee la velocidad de formación de los productos,
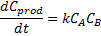
se verifica que:
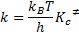
Esta es la ecuación de Eyring, que es la ecuación fundamental de la teoría del estado de transición.
