La Teoría de los Orbitales Atómicos
La Teoría de los orbitales atómicos presenta cierta dificultad en explicar los conceptos relativos a la distribución de electrones y al número de oxidación y polaridad de los átomos o iones involucrados en el enlace.
Existen dos teorías principales que intentan explicar la reorganización de los electrones en las moléculas: teoría del enlace de valencia (VBT) y teoría de los orbitales moleculares (MOT).
La teoría de enlace de valencia fue desarrollada por Linus Pauling. La teoría considera que átomos en moléculas se comportan como átomos aislados excepto para uno o más electrones – electrones de valencia – de la capa externa de un átomo que permanece en la capa externa de otro átomo.
Esta teoría explica bien las estructuras y propiedades magnéticas de complejos metálicos.
La teoría de los orbitales moleculares describe más precisamente la interacción de los átomos que forman las moléculas y la distribución de los electrones dentro de los átomos. Esta teoría también asume que una nueva serie de orbitales es creada (orbitales moleculares) cuando los átomos interactúan durante la formación del enlace.
La interacción de enlaces con el ion o metal de transición central es explicada por la teoría del campo cristalino.
La Teoría del campo cristalino busca explicar el enlace entre un ion central y los enlazates de ls siguiente forma:
Un ion con cierto valor para su número de oxidación puede recibir un número de enlazantes compatible con la reacción entre el radio del metal y el radio del enlazante y adquirir una configuración que vuelve mínima la repulsión entre los enlazantes.
La estabilidad final del ion complejo resulta más de la atracción entre el metal y los enlazantes que la repulsión entre los enlazantes.
Esta teoría, establecida en 1929, trata de la interacción de iones metálicos y enlazantes como un fenómeno puramente electroestático donde los enlazantes son considerados como puntos de cargas en las zonas vecinas de los orbitales moleculares del átomo central.
Esto se debe originalmente, a la teoría del campo cristalino desarrollada a través de la consideración de la forma como los niveles energéticos atómicos de los iones en un cristal eran afectados por sus alrededores iónicos.
El desarrollo y extensión de esta teoría han tomado en consideración la naturaleza parcialmente covalente de los enlaces entre los enlazantes y el átomo metálico central, principalmente a través de la aplicación de la teoría de los orbitales moleculares. Teoría del campo cristalino, siguiendo estas modificaciones y frecuentemente denominados como teoría del campo de enlazantes.
La teoría del campo cristalino verifica el efecto de los enlazantes sobre los orbitales d del ion metálico y establece una teoría unificada para explicar los colores, las propiedades magnéticas y estabilidad de los complejos y quelatos.
Las más notables propiedades físicas de los complejos o compuestos de coordinación son sus colores y sus magnetismos. Estas propiedades y algunas diferencias en sus estabilidades pueden ser explicadas en términos de la teoría del campo cristalino.
Esta teoría fue originalmente delineada para explicar los colores de los sólidos, particularmente el rubí, en los cuales los iones Cr3+ son responsables por el color. La versión más completa de esta teoría es denominada de teoría del campo de enlaces.
En la teoría del campo cristalino, cada posición de un enlazante (una base de Lewis) es representada por un punto de carga negativo. La estructura del complejo es entonces expresada en términos de interacciones electroestáticas – el campo – entre estos puntos de cargas y los electrones y núcleos del ion metálico central.
La geometría espacial de un complejo es determinada por el número de enlazantes que el mismo posee, o sea, su número de coordinación. Esta coordinación se refiere a los enlazantes coordinarse (enlazarse por coordinación) a los metales cuando surge la formación de los complejos.
Son conocidos complejos con número de coordinación de 2 hasta 9, siendo los más comunes los del número de coordinación 2,4 y 6 los cuales presentan las siguientes geometrías espaciales: lineal (2), tetraédrica (4), cuadrada plana (4) y octaédrica (6).
Ejemplos: [Cu(NH3)4]2+ = complejo tetraédrico; [Fe(CN)6]4- = complejo octaédrico.
La estructura cíclica de los quelatos, involucrando el ion metálico y los enlazantes dadores de electrones, provee a los citados compuestos una estabilidad muy grande, permitiendo en muchos casos la titulación directa del catión metálico con el agente quelante en presencia de un indicador adecuado.
El número de agentes quelantes es muy elevado y entre los más comunes, pueden ser citados los siguientes:
etilenodiamina, 8 – hidroxiquinolina, dimetilglioxima, sales sódicas del etilenodiaminotetraacético (EDTA) y varios otros.
Entre los agentes quelantes citados, el EDTA es uno de los más importantes, debido a las inumerables utilidades que presenta tanto en la química analítica, como en la industria y otros ramos de la actividad humana. El quelato, formado por la unión del ion EDTA con un catión metálico bivalente (Ca2+, Mg2+, Zn2+, etc.) presentaría la estructura esquematizada a continuación:
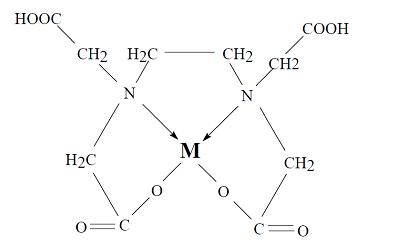
Representación esquemática del quelato formado de EDTA y un catión bivalente (M)
