Teoría de las Colisiones
La teoría de las colisiones propuesta por Max Trautz y William Lewis en 1916 y 1918, cualitativamente explica como reacciones químicas ocurren y porque las tasas de reacción difieren para diferentes reacciones.
Esta teoría está basada en la idea que partículas reactivas deben colisionar para que una reacción ocurra, pero solamente una cierta fracción del total de colisiones tiene la energía para conectarse efectivamente y causar transformaciones de los reactivos en productos. Esto es porque solamente una porción de las moléculas tiene energía suficiente y la orientación adecuada (o ángulo) en el momento del impacto para romper cualquier enlace existente y formar nuevas.
La cantidad mínima de energía necesaria para que esto suceda es conocida como energía de activación.
Partículas de diferentes elementos reaccionan con otras por presentar energía de activación con que aciertan las otras. Si los elementos reaccionan con otros, la colisión es llamada de suceso, pero si la concentración de al menos uno de los elementos es muy baja, habrá menos partículas para otros elementos reaccionar con aquellos y la reacción irá a suceder mucho más lentamente.
Con la temperatura aumentando, la energía cinética media y velocidad de las moléculas aumenta, pero esto es poco significativo en el aumento en el número de colisiones.
La tasa de reacción aumenta con la disminución de la temperatura porque una mayor fracción de las colisiones sobrepasa la energía de activación.
La teoría de las colisiones está íntimamente relacionada a la cinética química.
Los átomos de las moléculas de los reactivos están siempre en movimiento, generando muchas colisiones (choques). Parte de estas colisiones aumentan la velocidad de reacción química. Cuantos más choques con energía y geometría adecuada exista, mayor la velocidad de la reacción.
Hay dos tipos de colisiones:
- Horizontal – Colisión más lenta
- Vertical – Colisión más rápida, colisión efectiva
Veamos los dos modelos de colisiones para la formación de dos moléculas de HCl:
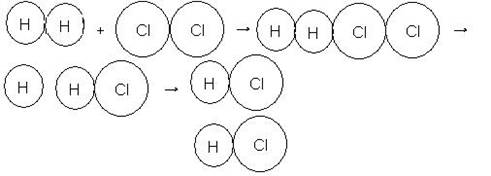
Colisión Horizontal:
Observemos que luego de la primer colisión existe formación de apenas una molécula de HCl. La segunda molécula se formará en la segunda colisión.
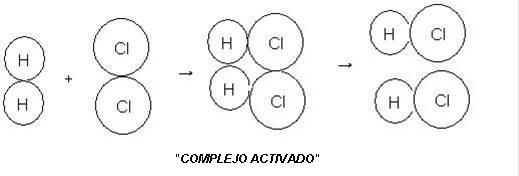
Colisión Vertical
Observe que la molécula de H2 se aproxima de la molécula de Cl2 con mucha velocidad. Enseguida, se chocan violentamente formando dos moléculas de HCl que se alejan enseguida.
La primera colisión forma el complejo activado (dos moléculas de HCl). Esta colisión sucede con mucha velocidad y por tanto más rápida y más efectiva. Torna la reacción química más rápida.
El estado intermedio de reacción, donde se forma el complejo activado es un estado de transición donde hay un alto valor de energía involucrado.
El complejo activado es la especie química con mayor valor energético en toda la reacción química que tiene vida muy corta.
ENERGÍA DE ACTIVACION (Eat)
Es la energía mínima que los reactivos precisan para que inicie la reacción química. Esta energía mínima es necesaria para la formación del complejo activado.
Cuanto mayor la energía de activación, más lenta es la reacción porque aumenta la dificultad para que el proceso suceda.
Cuanto menor la energía de activación, menor la barrera de energía, más colisiones efectivas y por tanto una reacción más rápida.
La energía de activación varía de acuerdo con el tipo de reacción química. En las reacciones endotérmicas ella es mayor que en las exotérmicas.
Donde:
Endotérmico
Exotérmico