Complejo ATP-Sintasa y Síntesis de ATP
El complejo ATP-Sintasa está formado por dos partes, el FO y el F1. El FO está compuesto por 3 tipos de sub-unidades en desigual número, las proteínas a(1), b(2) e c(9-12). Esos polipéptidos se encuentran insertados en la membrana tilacoidal, formando en su interior un canal protónico, a través del cual ocurre el flujo de protones desde el lumen hasta el estroma.
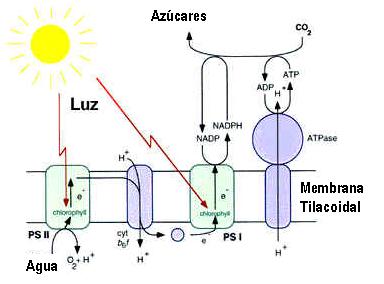
El F1 está compuesto de por lo menos 5 polipéptidos extrínsecos (α , β , d , g , e), formando una estructura esférica, que contiene sitios catalíticos para la síntesis de ATP. La energía del gradiente electroquímico de protones, creado durante el transporte de electrones entre los fotosistemas, es utilizada para la síntesis de ATP por medio del mecanismo quimiosmótico propuesto por Peter Mitchell en 1960.
ADP-3 + Pi-2 + H+ =========> ATP-4 + H2O
Según ese mecanismo, que le ofreció el Premio Nobel de Química a Mitchell, en 1976, la diferencia de concentración de iones y la diferencia de potencial eléctrico a través de la membrana son las fuentes de energía libre utilizada para sintetizar ATP.
Mitchell propuso que la energía total disponible para la síntesis de ATP, denominada como fuerza protón motora (Δp), resulta de la suma del potencial químico de protones (ΔpH) y del potencial eléctrico transmembrana (ΔΨ):
Δp = ΔpH + Δ Ψ
La explicación del mecanismo enzimático de la síntesis de ATP fue realizada por Paul Boyer y John Walker. Estos investigadores obtuvieron el premio Nobel de Quimica en 1997 por este descubrimiento.
Boyer y colaboradores clarificaron la estructura tridimensional de la ATP-Sintasa (figura a continuación).
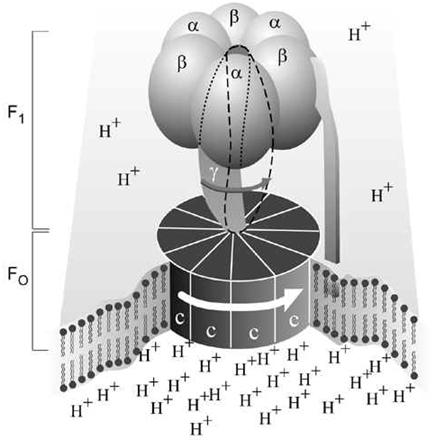
Estructura tridimensional de la ATP-Sintasa
Según el mecanismo propuesto por Boyer y Walker, cuando los iones hidrógeno fluyen a través de la membrana por el disco formado por las subunidades C de la parte Fo, el disco es obligado a girar. Ese giro obliga a rotar la subunidad gamma de la parte F1 que se encuentra ligada a ese disco. Las tres subunidades beta y alfa de la parte F1 no pueden girar por encontrarse ancladas por la subunidad b.
La subunidad gamma rota dentro del cilindro formado por las 6 subunidades alfa y beta. Dado que la subunidad gamma es asimétrica, su rotación provoca cambios estructurales en la subunidad beta. La subunidad beta cambia de tres formas βO , βL y βT.
Los cambios estructurales en la subunidad beta permite que el ADP y el ATP queden enlazados con diferente fuerza (figura a continuación)
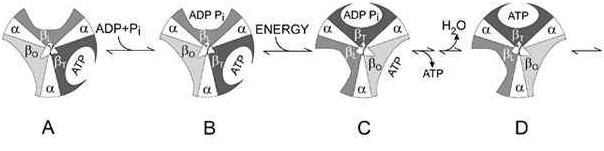
Etapas de la síntesis del ATP. La subunidad asimétrica g provoca los cambios conformativos de la subunidad β. En el estado A, βO se encuentra abierto, βL lista para recibir ADP y Pi en tanto que βT con una molécula de ATP ya formada. En los siguientes estados B, C y D, la subunidad β va cambiando de conformación, posibilitando la formación y liberación continua de ATP.
