Mecanismos de Transporte y Conductancia Electromagnética
Existen tres formas por las cuales ocurren movimientos de iones o moléculas neutras en una solución: difusión, convección y migración.
DIFUSIÓN
Es el movimiento de iones o especies neutras debido a la existencia de gradientes de potencial químico o gradientes de concentración. En un sistema electroquímico, el fenómeno de difusión puede aparecer como consecuencia de la reacción electrolítica.
Como esta reacción ocurre apenas en la interfase electrodo/solución. Cuanto mayor es la corriente, mayor será el consumo de reactivo y por tanto, mayor será la disminución de la concentración hasta que, en el límite, par corriente muy elevada, la concentración superficial tenderá a 0. En estas circunstancias el fenómeno difusor que es consecuencia de los gradientes de concentración controla el proceso.
CONVECCIÓN
Es el movimiento de iones o especies neutras resultante de la agitación de la solución. Por ejemplo, reacciones exotérmicas pueden producir gradientes de temperatura y como consecuencia, gradientes de densidad al interior del sistema electroquímico que, por acción de la gravedad, puede llevar a la circulación del electrolito. Por otra parte, el fenómeno convectivo puede ser provocado también por agitación externa.
MIGRACIÓN
Es el movimiento de especies iónicas debido a la acción de campos eléctricos o gradientes de potencial eléctricos. Es el fenómeno responsable por la conducción de electricidad en los electrolitos.
Este tema es bastante importante desde el punto de vista electroquímico y se trata sistemáticamente en los cursos de la materia.
Cualquier conductor metálico o electrolítico está caracterizado por una magnitud eléctrica denominada como “resistencia específica” o “mis-relatividad” (ρ). Una porción del electrolito de longitud l y área A tendrá una resistencia eléctrica que puede ser expresada por la relación.
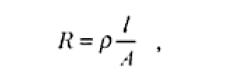
donde las unidades más adoptadas son cm para l, cm2 para A y Ωcm para ρ. Valores típicos de la resistividad para los conductores electrolíticos y conductores metálicos son, respectivamente ρ≡ 10 Ωcm para solución de KCl 1 N y ρ≡ 10-6 Ωcm para el cobre metálico.
Para soluciones electrolíticas es común que se utilice otra magnitud: la conductancia específica o conductividad del electrolito k, que es igual al inverso de la resistencia específica. Comúnmente, esta magnitud es normalizada a través de la división por la concentración normal del electrolito c, resultando en la conductividad equivalente del electrolito Λ.
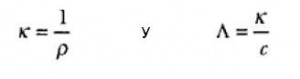
Siendo las unidades expresadas por:
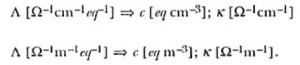
Otro concepto importante introducido en la teoría de la conductancia es el del número de transporte (ti) que representa la fracción de la corriente eléctrica total transportada por una dada especie iónica presente en la solución. El número de transporte es mensurable experimentalmente, lo que permite introducir el concepto de conductividad iónica equivalente (λi = ti Λ) que representa a una dada concentración a contribución de cada especie iónica a la conductividad equivalente del electrolito (por ejemplo para un electrolito univalente Λ = λ+ + λ– ). Las medidas experimentales de Λ y de t muestran que estos parámetros son dependientes de la concentración del electrolito, de la temperatura y de la naturaleza de los iones involucrados en el transporte de la electricidad.
