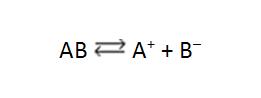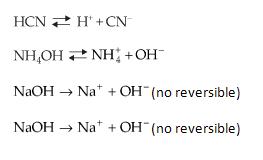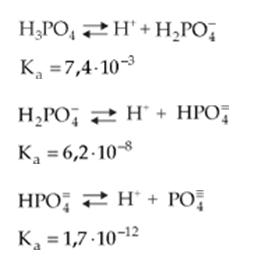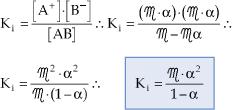Equilibrio Iónico y Ley de Dilución de Ostwald
Considere el electrolito AB en solución acuosa:
Su ionización (si AB es molecular) o su disociación (si AB es iónico) también es un fenómeno reversible y, siendo así, llegará luego de determinado tiempo, el equilibrio químico. Este equilibrio será llamado desde ahora como equilibrio iónico porque aparecen iones. Importante destacar que, en el caso de bases fuertes y sales solubles, no podemos hablar en equilibrio iónico, ya que la reacción inversa no se procesa (la disociación no é reversible).
Ejemplos
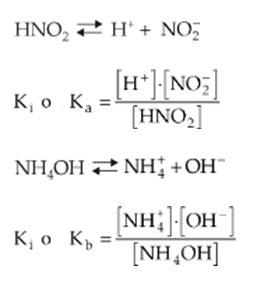
Si consideramos la ionización del HNO2:
A ejemplo de equilibrios anteriores, podemos escribir que su constante de equilibrio es:
Esta constante de equilibrio, Kc, recibe el nombre particular de constante de ionización o constante de disociación iónica y es representada por Ki, Ka (en el caso de ácidos) o Kb (en el caso de bases).
Observaciones
a) Ki varía con la temperatura.
b) Cuando la ionización de un electrolito presente varias etapas, tenemos para cada etapa una constante de ionización:
Observe que la primera constante de ionización de ácido fosfórico es mayor que la segunda, que, por su vez, es mayor que la tercera, indicando que la primera ionización de un electrolito ocurre más intensamente que las otras posteriores.
c) Valores altos de Ki indican electrolitos fuertes que son, por lo tanto, muy disociados o ionizados; mientras valores bajos indica que el electrolito es débil.
En la siguiente tabla, tenemos valores de Ka de algunos ácidos:
| Ácido | Temp (ºC) | Ka | Fuerza |
| HCN | 18 ºC | 4,7 x 10-10 | Muy débil |
| H3CCOOH | 20 ºC | 1,3 x 10-5 | Débil |
| HNO2 | 20 ºC | 7 x 10-4 | Moderado |
| HI | 25 ºC | 3 10+9 | Fuerte |
Ley de Dilución de Ostwald
Llamamos el grado de ionización de un electrolito, que puede ser definido como la fracción del mol que está ionizada en la solución. Por lo tanto, para cada mol que fue inicialmente disuelto, a representa la parte que se ionizó. De forma general, tenemos:
Considere el equilibrio:
AB <==> A+ + B–
A partir de la concentración molar (M) y del grado de ionización (α), podemos relacionar Ki y α:
| Inicial |  |
| Reacciona | |
| Forma | |
| En equilibrio |
Esta fórmula es la Ley de Dilución de Ostwald y permite concluir que, cuanto menor es la concentración de un electrolito, mayor será su grado de ionización, lo que significa decir que el grado de ionización aumenta a la medida en que se diluye la solución.
Para electrolitos débiles, en los que los valores de α son muy pequeños, podemos considerar 1 – α como siendo prácticamente 1, lo que simplifica la ecuación de Ostwald para:
Efecto del Ion Común
Efecto del ion común es el nombre que se da a la aplicación del principio de Le Chatelier (desplazamiento del equilibrio) para equilibrios iónicos.
Ejemplo
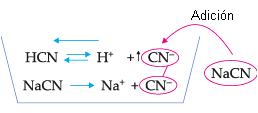
Considere el equilibrio que se establece cuando HCN es colocado en agua:
HCN <==> H+ + CN–
Supongamos que se añade a la solución cianato de sodio (NaCN). Como NaCN es iónico, su disociación es total:
NaCN = = > Na+ + CN–
El ion CN– originario del cianato de sodio es común al equilibrio del ácido; luego, su concentración aumentará, lo que provocará el desplazamiento del equilibrio hacia la izquierda, en el sentido de formar HCN, disminuyendo, por lo tanto, la ionización del ácido.
El hecho de que el grado de ionización de un electrolito disminuya por la adición, en la solución, de otro electrolito que posea un ion igual a uno de los iones del 1o electrolito recibe el nombre de efecto de ion común.
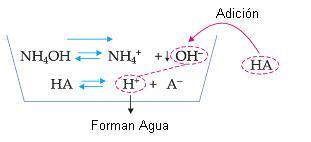
Es importante recordar que hay iones que, aunque no sean comunes al equilibrio iónico, también pueden desplazarlo. Tomemos, por ejemplo, la disociación de NH4OH:
Si a esta solución añadimos un ácido cualquiera, estaremos añadiendo H+, que reaccionará con los iones OH– de la base, formando agua.
La concentración de iones OH– disminuirá y, por lo tanto, el equilibrio será desplazado hacia la derecha, aumentando la disociación de la base.