Fuerza intermolecular
Cuando dos moléculas se aproximan existe una interacción de sus campos magnéticos lo que hace surgir una fuerza entre ellas. Es lo que llamamos como fuerza intermolecular. Esas fuerzas varían de intensidad, dependiendo del tipo de la molécula (polar o apolar) y en el caso de las polares, de cuan polares ellas son.
Observación importante: La teoría cinética de los gases asume que la distancia entre las moléculas es tan grande que no existe fuerza de atracción entre ellas. En estado líquido y sólido las moléculas están muy próximas y la fuerza atractiva puede ser observada.
Veamos entonces como son las fuerzas cuando las aproximamos:
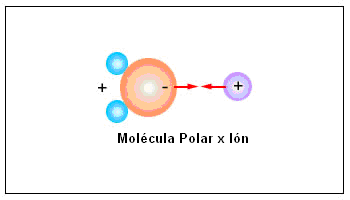
Ión y la molécula polar: Es la fuerza más intensa y su magnitud puede ser compatible a la de un enlace covalente.
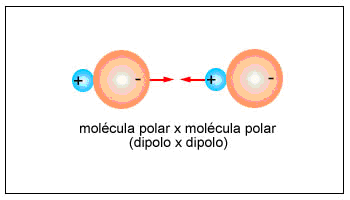
Molécula polar y otra Molécula Polar: Ocurre entre moléculas polares de la misma sustancia o de sustancias diferentes, ambas polares. Esta fuerza es muy conocida como dipolo-dipolo o dipolo permanente.
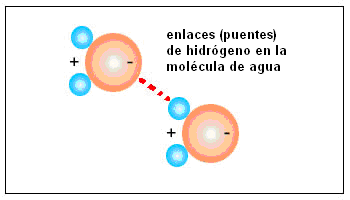
Enlaces o puentes de hidrógeno: Cuando enlazado a un átomo pequeño y de fuerte electronegatividad (F, O o N), el hidrógeno forma enlaces polares muy fuertes. Sus polos interactuarán fuertemente con otras moléculas polares, formando una fuerte red de enlaces intermoleculares.
Molécula polar y una molécula apolar: Conocida como interacción dipolo x dipolo inducido, ocurren porque moléculas polares (dipolos permanentes) logran distorsionar la distribución de carga en otras moléculas vecinas, a través de polarización inducida.
Una interacción de ese tipo es una interacción débil.
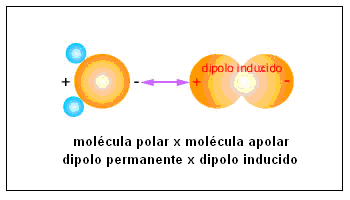
Esas intracciones son responsables, por ejemplo, por la solubilidad de gases como el O2 (apolar) en agua.
Molécula apolar y una molécula apolar: El movimiento de los electrones permite que, en determinado momento, moléculas apolares logren inducir un dipolo en su molécula vecina y esta, una vez polarizada de secuencia al efecto. Esas fuerzas fueron notadas por el físico Polonés Fritz London, que sugirió que las moléculas apolares podrían volverse dipolos temporarios. Esas fuerzas fueron conocidas como fuerzas de dispersión o fuerzas de London.
Donde actúan las fuerzas intermoleculares
La fuerza intermolecular es responsable por algunos fenómenos muy comunes, como la capilaridad y la tensión superficial. Cuando tomamos una toalla de papel y colocamos apenas una de sus puntas en contacto con el agua. Luego de unos instantes, toda la toalla está húmeda.
Ese ascenso del agua por algunas superficies o tubos capilares se llama capilaridad. El hecho de que una aguja flote sobre la superficie del agua, aún siendo más densa que ella y el caminar de un insecto sobre la superficie solo es posible por la tensión superficial, una especia de fina capa que se forma en los líquidos.
Puentes de Hidrógeno
Si no existiesen los puentes de hidrógeno, el agua tendría su punto de ebullición cerca de los -90ºC lo que tornaría su existencia imposible en la Tierra.
Concepto de Capilaridad
El agua llega a una flor, subiendo por su tallo. Ese es un buen ejemplo para el fenómeno de la capilaridad. Cuando recibimos flores y las colocamos en un jarrón, es un hábito muy común, cortar la punta inferior de los tallos. Para evitar que el aire entre en los pequeños vasos que existen en el tallo e interrumpan la capilaridad para evitar el contacto entre moléculas del agua, debemos hacer el corte del tallo dentro del jarrón con agua y sus flores, durarán al menos un poco más de tiempo.
