Radio de Van der Waals
Si consideramos dos átomos neutros separados por una distancia considerable, observaremos que no hay fuerzas que actúen sobre ellos. Sin embargo, si disminuimos la distancia que separa dichos átomos, observaremos que aparece una fuerza de atracción entre ellos.
Cuanto menor es la distancia, mayor es la fuerza que los atrae. Esta atracción está dada en gran parte por las fuerzas de London, que se deben a que el movimiento de la nube de electrones alrededor de un átomo o una molécula crea un dipolo parcial temporal, dejando sobre un lado de la molécula las cargas positivas y sobre el otro lado las cargas negativas.
Estas cargas parciales temporales hacen que las moléculas se atraigan entre si. Las fuerzas de London se dan en las moléculas polares y no polares. Pero además, en las moléculas polares, existe otra fuerza de atracción entre ellas, y es la atracción dipolo- dipolo.
Cada molécula polar tiene un dipolo negativo y uno positivo, y los dipolos de cargas distintas, de diferentes moléculas se atraen. Sin embargo, cuando la distancia entre los átomos es muy pequeña, aparece una fuerza de repulsión, dada por las nubes de electrones de los átomos en cuestión, que se repelen por tener cargas negativas.
Se le llama radio de Van der Waals de un átomo a la distancia mínima a la cual podríamos colocar una carga negativa, sin que la nube de electrones del átomo en cuestión la rechace. A esta distancia, la fuerza de London es máxima. La distancia mínima entre dos átomos es en realidad la suma de sus radios de Van der Waals. (dado que ambos tienen electrones a su alrededor).
El radio de Van der Waals sería como la frontera del átomo, si lo imaginamos como una esfera rígida. Para aproximar dos átomos a una distancia menor que la suma de sus radios de Van der Waals se necesita realmente mucha energía, si no está enlazados covalentemente entre si.
Además, es importante destacar que el radio de Van der Waals es un valor promedio y no una medida exacta. Esto se debe a que los electrones están en constante movimiento, lo que hace que la nube electrónica del átomo no sea una esfera perfecta y su tamaño varíe. Por lo tanto, el radio de Van der Waals es una medida de la distancia a la que un átomo interactúa con otro en promedio.
Si consideramos dos iones de carga distinta, éstos de atraerán con una fuerza mayor a la de London, pudiendo establecerse un enlace iónico. El radio iónico, es decir la distancia a la cual los iones formarán un enlace, no coincide con el radio de Van der Waals del átomo neutro, siendo por lo general mayor en los aniones y menor en los cationes.

Supongamos dos átomos representados como dos esferas rígidas, cuyo radio es el radio de Van der Waals correspondiente para cada átomo. Si éstos se enlazan covalentemente, las esferas se intersectan, ya que la distancia entre dos átomos unidos covalentemente es menor a la suma de sus radios.
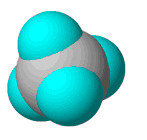
Molécula de Metano: la esfera central representa el carbono, intersectadas por cuatro esferas que representan átomos de hidrógeno, unidos covalentemente
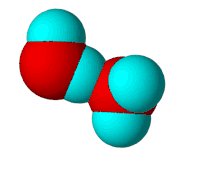
Moléculas de agua unidas por puente de hidrógeno: el puente también acerca los átomos más allá de su radio de Van der Waals.
El radio de Van der Waals es un concepto fundamental en la química y la física de las moléculas. No solo nos ayuda a entender cómo y por qué los átomos y las moléculas interactúan entre sí, sino que también es esencial para la comprensión de muchos fenómenos físicos y químicos, como la formación de enlaces químicos, las propiedades de los gases, la solubilidad de las sustancias, la formación de cristales y muchas otras propiedades y comportamientos de la materia.
