Interacción Ion-Dipolo
La interacción ión-dipolo es una fuerza intermolecular que se da cuando los iones de una sustancia interactúan con los dipolos de una molécula covalente polar.
En un enlace polar, el átomo con mayor electronegatividad atrae los electrones hacia sí, generando un dipolo negativo en torno a sí mismo, mientras que se forma un dipolo positivo en el área del átomo con menor electronegatividad.
Recordemos que la electronegatividad es la fuerza de atracción ejercida sobre los electrones de un enlace. Ella es considerada como una propiedad periódica, o sea que, a medida que el número atómico aumenta, asume valor creciente o decreciente en cada período de la tabla periódica de elementos.
Los átomos ejercen una fuerza de atracción sobre los electrones de un enlace y esa fuerza se relaciona con el radio atómico, porque cuanto menor el tamaño del átomo, mayor será la fuerza de atracción.
La manera de saber sobre la electronegatividad de un átomo, es observando su posición en la Tabla Periódica, la electronegatividad crece desde abajo hacia arriba y de izquierda a derecha.
En la interacción ión-dipolo, el catión sufre atracción electrostática por el dipolo negativo, mientras que el anión es atraído por la fuerza electrostática hacia el dipolo positivo.
El clásico ejemplo de la interacción ión-dipolo es la solución acuosa de cloruro de sodio (NaCl). En esta sal, el enlace es iónico. Entonces cuando se disuelve en agua, se disocia completamente en cationes Na+ y aniones Cl-.
En la molécula de agua, el átomo de oxígeno tiene mayor electronegatividad que el de hidrógeno, por lo tanto existe un dipolo negativo en torno al oxígeno, y un dipolo positivo en torno al átomo de hidrógeno.
Entonces los cationes Na+ sufren atracción electrostática por el dipolo negativo del átomo de oxígeno, y los aniones Cl-, sufren fuerza de atracción electrostática por el dipolo positivo del hidrógeno.
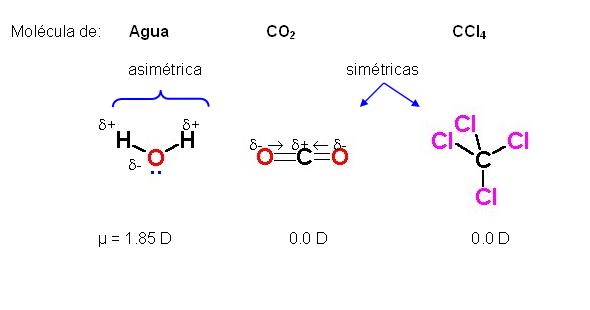
Para poder intervenir en interacciones ión-dipolo, las moléculas polares tienen que tener momento dipolar distinto de cero.
En moléculas tales como el CO2 o el CCl4 , a pesar de las diferencias de electronegatividad entre los átomos de oxígeno y carbono, para el primer caso, y de carbono y cloro, para el segundo caso, el momento dipolar es cero.
Esto sucede porque son moléculas simétricas, y los vectores de los momentos dipolares parciales de cada enlace covalente se anulan entre sí.
De todos modos, moléculas con momento dipolar igual a cero, pueden tener dipolos transitorios si son sometidas a un campo eléctrico. En este caso se observarán interacciones ión-dipolo inducido. La magnitud de esta interacción depende de la capacidad de la molécula para que se le induzca un dipolo. Esta característica se denomina polarizabilidad.
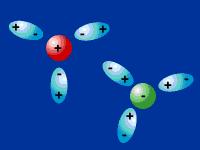
En la figura de arriba se representa la interacción entre un catión y moléculas polares, y un anión y moléculas polares.
La energía de interacción (E), entre un ión y un dipolo, depende de la carga del ión (Q), de la distancia entre ellos (d) y del momento dipolar (m )de la molécula polar, según la siguiente fórmula:
![]()
Además de la solución acuosa de cloruro de sodio, hay otros ejemplos de interacciones ión-dipolo que son relevantes en la química. Por ejemplo, en la solución acuosa de sulfato de cobre (CuSO4), el catión Cu2+ interactúa con las moléculas de agua, formando una especie de «capa» de moléculas de agua alrededor del catión. Este fenómeno se conoce como hidratación y es un caso particular de la interacción ión-dipolo.
Además, las interacciones ión-dipolo son fundamentales en procesos biológicos, como la formación de complejos enzima-substrato. Las enzimas, que son proteínas, tienen grupos funcionales polares que pueden interactuar con los iones presentes en el substrato, facilitando la reacción química.
También es importante destacar que la interacción ión-dipolo es más fuerte que otras interacciones intermoleculares, como las fuerzas de Van der Waals o las interacciones dipolo-dipolo. Esto se debe a que la carga de un ión es mucho mayor que el momento dipolar de una molécula polar.
Por último, cabe mencionar que la interacción ión-dipolo es una de las fuerzas que contribuyen a la solubilidad de las sales en agua. Cuando una sal se disuelve en agua, los iones de la sal interactúan con las moléculas de agua, formando nuevas interacciones ión-dipolo que compensan la energía necesaria para romper las interacciones iónicas en la red cristalina de la sal.
