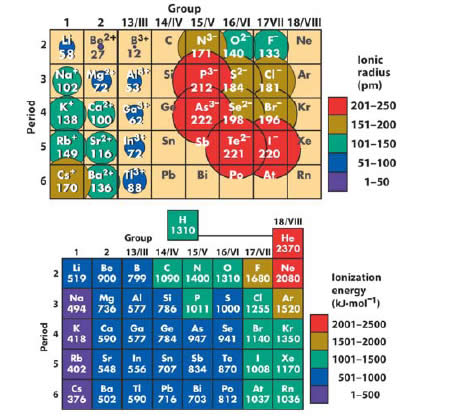
Estructura Electrónica – Tabla Periódica
La primera energía de ionización generalmente decrece en un grupo. Con pocas excepciones la primer energía de ionización aumenta desde la izquierda para la derecha en el período y cae para valores más bajos en el inicio del período siguiente.
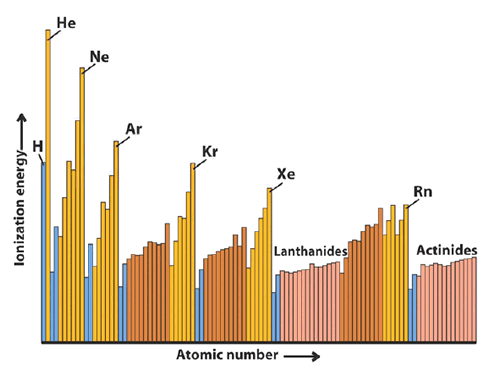
Los electrones más externos son más fácilmente removidos al decrecer en un grupo. A medida que el átomo aumenta, se vuelve más sencillo remover un electrón del orbital más voluminoso.
Generalmente la energía de ionización aumenta a lo largo del período. A lo largo de un período, Zef aumenta. Consecuentemente, se hace más sencillo remover un electrón.
Existen dos excepciones: la remoción del primer electrón p y la remoción del cuarto electrón p.
Excepciones de la energía de ionización

Los electrones s son más eficaces en la protección de que los electrones p.
Consecuentemente, la formación de s2p0 se tornará más favorable.
Cuando un segundo electrón es colocado en un orbital p, aumenta la repulsión electrón- electrón. Cuando ese electrón es removido, la configuración s2p3 resultante es más estable que la configuración inicial s2p4 . Por tanto, hay una disminución en la energía de ionización.
Configuraciones electrónicas de los iones
Cationes: Los electrones son primeramente removidos del orbital con el mayor número cuántico principal, n:
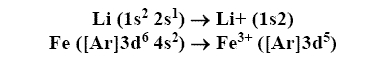
Aniones: Los electrones son adicionados al orbital con el más bajo valor n disponible:
![]()
Afinidad electrónica Eae
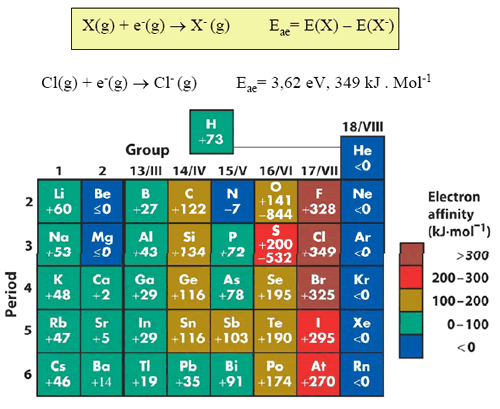
La afinidad electrónica de un elemento es la energía liberada cuando un electrón se enlaza a un átomo en la fase gaseosa.
La afinidad electrónica es mucho menos periódica que el radio atómico y la energía de ionización. Entre tanto, una tendencia es claramente visible, las afinidades electrónicas son mayores en la parte superior derecha de la tabla periódica.
Los valores positivos de afinidad electrónica dicen que luego de la adición del electrón la energía es liberada. Para valores positivos, se hace necesaria la energía para adicionar el electrón al elemento. En algunos libros, estas señales son invertidos, pues se refieren a valores de entalpía.
Efecto del par inerte
Efecto del par inerte es la tendencia a iones con carga dos unidades más baja de lo que la esperada para el número del grupo.
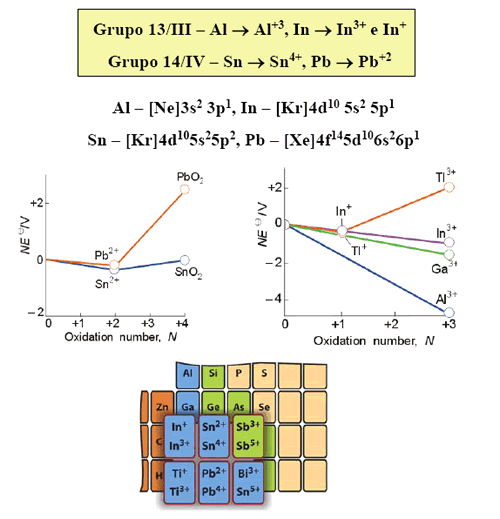
El efecto del par inerte es debido en parte, a las energías relativas de los electrones de valencia s y p. En los períodos más tardíos de la tabla periódica, los electrones de valencia s tienen energía muy baja por causa de su buena penetración y de la baja capacidad de blindaje de los electrones d. Por tanto ellos pueden permanecer enlazados al átomo durante el proceso de ionización.
Relaciones Diagonales
Las relaciones diagonales son semejanzas de propiedades entre vecinos diagonales en los grupos principales de la tabla periódica.
La relación diagonal se debe en parte a las características de radio atómico y energía de ionización de esos elementos.