Tabla Periódica: Elementos químicos
 La Tabla Periódica, agrupa, organiza y divide, los elementos químicos según sus propiedades y características. Ya a principios del siglo XIX, la cantidad de elementos químicos que se conocía, era bastante grande como para necesitar algún tipo de orden o clasificación, con el fin de facilitar el estudio y comprensión de las distintas propiedades.
La Tabla Periódica, agrupa, organiza y divide, los elementos químicos según sus propiedades y características. Ya a principios del siglo XIX, la cantidad de elementos químicos que se conocía, era bastante grande como para necesitar algún tipo de orden o clasificación, con el fin de facilitar el estudio y comprensión de las distintas propiedades.
Casi desde el principio, se comprobó que los elementos podían agruparse por familias de elementos, ya que muchos poseían muchas similitudes entre sí, se dedujo que debía de existir alguna ley natural que los agrupase y relacionase. La investigación de esta ley, está llena de numerosos tentativos, los cuales se basaban generalmente en dos criterios esenciales:
- La similitud de las propiedades físicas y químicas de los elementos, así como también de sus compuestos.
- La relación entre las propiedades y las características de cada átomo, sobretodo con las masas atómicas
Hubo diversos intentos, dignos de mención, como fueron las tríadas de Böbereiner en 1817, las octavas de Newlands en 1866, o el tornillo telúrico de Charcourtois en 1862.
El científico ruso D. Mendeleiev y el alemán L. Meyer, presentaron por separado en el 1869 y 1870, su famosa Tabla Periódica.
La ordenación periódica de Mendeleiev, fue más elaborada que la de Meyer, y se basaba en ordenar los elementos de menor a mayor, según su masa atómica y en la similitud de las propiedades.
Fue así como ordenó a los elementos en líneas horizontales, donde la masa atómica crecía de izquierda a derecha, y verticalmente formando columnas, agrupaba a los elementos según sus semejanzas en las propiedades. Mendeleiev dedujo que las propiedades de los elementos respondían a alguna ley, una ley periódica, que aún se desconocía.
La búsqueda de está ley, lo llevó a arriesgarse con sus predicciones, que con el tiempo, se confirmaron como correctas. Cambió el valor de la masa atómica de elementos como, el indio, berilio y uranio, dándoles otro valor que el consideraba mejor, para así poderlos clasificar con mayor facilidad de acuerdo con sus propiedades.
También alteró el orden de algunas masas atómicas para que los elementos quedasen agrupados con otros de sus mismas características. Esto ocurrió por ejemplo, con el teluro-yodo o el cobalto-níquel.
Todo esto le llevó a dejar huecos en la tabla, que supuso que correspondían a elementos que aún no se habían descubierto, pero de los cuales ya podía predecir sus propiedades. Fue el caso de elementos como el galio, el germanio o el escandio.
La clasificación expuesta por Mendeleiev y Meyer sufrió numerosas modificaciones con el tiempo, pero aún así, mantuvo el principal criterio, que era considerar la masa atómica como criterio de ordenación, aunque eso supusiera colocar algunos elementos fuera de su lugar lógico para ordenarlos según sus propiedades.
No se sabía cual sería la propiedad esencial en la cual se basaba la ley periódica, pero si se deducía que había que compatibilizar las propiedades químicas de los elementos y sus masas atómicas, aunque esto suponía una ordenación no del todo coherente.
Esta duda quedo sin respuesta hasta 1914, cuando H. Moseley, definió el número atómico de los elementos, y comprobó que si se hacía una colocación por orden creciente de número atómico, todos los elementos quedaban situados e el lugar lógico siguiendo el criterio de la similitud de propiedades.
La ley periódica se enuncia actualmente como:
“Cuando los elementos se colocan en orden creciente de su número atómico, tiene lugar una repetición periódica de ciertas propiedades físicas o químicas de aquéllos”.
La periodicidad en las propiedades químicas de los elementos, se centra en la configuración electrónica, repitiéndose ésta periódicamente.
Las propiedades físicas y químicas que se repiten con mayor regularidad a lo largo de grupos y períodos son: los radios atómicos e iónicos, la energía de ionización, la afinidad electrónica, la electronegatividad y el carácter metálico.
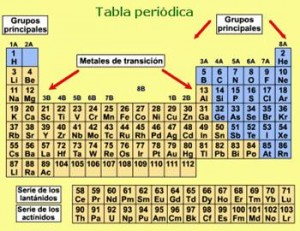
La Tabla Periódica actual, la debemos a Paneth y Werner. En ella los elementos conocidos hasta el momento, se clasifican en orden creciente de su número atómico, distribuidos en dieciocho columnas (llamadas grupos) y siete filas, que reciben el nombre de períodos. Toda la Tabla está estructurada según la configuración electrónica, que es la verdadera responsable de las propiedades de los elementos.
Los períodos se clasifican por números correlativos del 1 al 7, donde los elementos van variando progresivamente su comportamiento, desde el metálico hasta el no metálico, acabando siempre con un gas noble.
Los grupos también se designan con números consecutivos, que van del 1 al 18.
Los elementos que conforman cada grupo tienen por lo general, propiedades químicas símiles, debido a que todos coinciden n su configuración electrónica.
- Los grupos 1 y 2, corresponden a los elementos metálicos
- Los grupos del 3 al 12, son ocupados por los metales de transición
- Los grupos del 13 al 17, están formados por los no metales y los semimetales
- El grupo 18, queda constituido por los gases nobles.
Los grupos 1, 2 y del 13 al 18, están formados por elementos que se conocen como elementos representativos. Algunos de estos grupos reciben nombres especiales:
- Grupo 1 → Alcalinos
- Grupo 2 → Alcalinotérreos
- Grupo 16 → Calcógenos
- Grupo 17 → Halógenos
- Grupo 18 → Gases nobles
Entre los metales de transición se encuentran unos elementos conocidos como “tierras raras” o metales de transición interna: lantánidos y actínidos. Suelen colocarse formando dos filas de catorce columnas separados del resto de la tabla.
