Ecuación de Kapustinskii
La energía del retículo cristalino de un compuesto iónico, es definida como la energía liberada cuando los iones separados a una distancia infinita son aproximados para formar un cristal:
M+2(g) + 2X–(g)=MX2(cr)
donde M y X serían un metal y un halógeno, siendo MX2 haluro magnético.
Kapustinskii observó que, si las constantes de Madelung para una serie de compuestos iónicos con diferentes estructuras, son divididas por el número de iones en su fórmula unitaria, los valores obtenidos son prácticamente constantes, lo que llegó a proponer que sería posible obtenerse una ecuación general par la energía reticular, que podría ser aplicada a cualquier compuesto iónico, independiente de su estructura.
Así, la energía involucrada en la reacción presentada más arriba, puede ser estimada utilizándose la llamada ecuación de Kapunstinkii, que por su parte, es una modificación de las Ecuaciones de Born-Mayer y Born-Landé.
ΔHL = (-n.z+.z–.102/d).(1-d*/d).K
Donde z+ y z- son respectivamente la carga del catión y del anión n el número de iones por fórmula unitaria, d siendo la suma del radio del catión y del radio del anión (para número de coordinación 6) y d* y K son constantes con valores de 34,5 pm (para los haluros alcalinos) y 1,21 pm MJ. mol-1 respectivamente.
La Ecuación de Kapunstinkii:
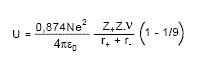
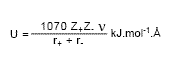
v = número de iones en la fórmula molecular
Útil para estimar energías reticulares, entalpías de formación y radios termoquímicos.
Parámetro electroestático: ξ ∞ Z 2/r
Los haluros químicos son compuestos químicos que contienen átomos de los elementos del grupo VII halógenos (flúor (F), cloro (Cl), bromo (Br), yodo (I) y Astato (At), en estado de oxidación -1. Sus características químicas y físicas los hacen ser parecidos al cloruro y hasta el ioduro, siendo una excepción el floruro.
Pueden ser formados directamente desde los elementos o a partir del ácido HX (donde X= F, Cl, Br, I) correspondiente con una base.
La energía reticular es aquella energía para separar completamente un mol de un compuesto sólido iónico en sus iones gaseosos.
La constante de Madelung, es un número adimesional relacionado a las características geométricas del sólido. La energía será mínima (energía de red = – Er) cuando la distancia de equilibrio de separación de los iones es alcanzada (r = ro). En este caso, la ecuación 1 puede ser escrita como:
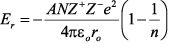
El valor de la energía de red será mayor cuando los iones fuesen similares en tamaño, especialmente si fuesen pequeños y con carga elevada. La presencia de cationes mucho mayores que aniones y viceversa, puede reducir el valor de Er.
La energía de solvatación total es la suma de las energía de solvatación de dos iones individuales y está directamente relacionada a la habilidad inherente del solvente para coordinar los iones involucrados y la naturaleza de esos iones.
Además de su utilidad para estimar energías reticulares, la ecuación de Kapustinskii también puede ser utilizada para calcular la energía de formación de un compuesto iónico a partir de sus iones gaseosos. Esto es especialmente útil en el estudio de la termodinámica de las reacciones químicas, ya que permite predecir la dirección en la que se llevará a cabo una reacción bajo ciertas condiciones.
Es importante mencionar que la ecuación de Kapustinskii es una aproximación y, como tal, tiene sus limitaciones. Por ejemplo, asume que los iones son esferas rígidas y que la red cristalina es perfecta, lo cual no siempre es cierto en la realidad. Sin embargo, a pesar de estas limitaciones, la ecuación de Kapustinskii proporciona una buena estimación de la energía reticular en la mayoría de los casos.
La ecuación de Kapustinskii también ha sido utilizada para estudiar la estructura de los cristales iónicos. Por ejemplo, puede ser utilizada para determinar la distancia entre los iones en un cristal, lo cual es útil para entender cómo se organizan los iones en el cristal y cómo esta organización afecta las propiedades del material.
En el campo de la química de materiales, la ecuación de Kapustinskii ha sido utilizada para diseñar nuevos materiales con propiedades específicas. Por ejemplo, puede ser utilizada para predecir la estabilidad de un material bajo ciertas condiciones, lo cual es útil para el diseño de materiales que pueden resistir condiciones extremas, como altas temperaturas o presiones.
En resumen, la ecuación de Kapustinskii es una herramienta valiosa en el estudio de los compuestos iónicos y sus propiedades. Aunque tiene sus limitaciones, proporciona una buena aproximación de la energía reticular y puede ser utilizada para predecir una variedad de propiedades de los compuestos iónicos.
