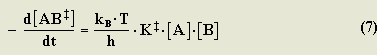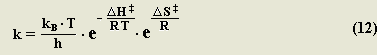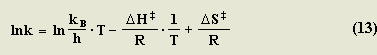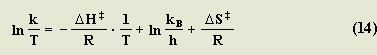Ecuación de Eyring
La ecuación de Eyring, así como la de Arrhenius, describen la relación entre temperatura y velocidad de reacción. Estrictamente hablando, la ecuación de Arrhenius sólo puede ser aplicada a la cinética de reacciones en gases.
En cambio la ecuación de Eyring es usada también en el estudio de reacciones en soluciones y otros casos donde el modelo de colisión simple no es de gran ayuda.
La ecuación de Arrhenius está basada en la observación empírica que relaciona la temperatura con la velocidad de una reacción, mientras que la ecuación de Eyring es una construcción teórica, basada en el modelo de estado de transición.
Supongamos una reacción entre dos moléculas A y B, que reaccionan para obtener un producto C:
La velocidad de reacción estará dada por la siguiente ecuación:
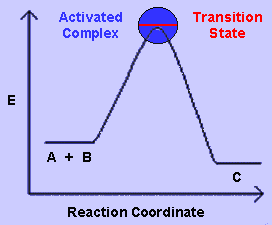
Tomando en cuenta la teoría de transición de estado, A y B se encontrarán en un estado de transición inestable ( AB ‡) , antes de convertirse en C.
Existe una “barrera de energía” en el camino entre los reactantes A y B y el producto C. Esta barrera determina un mínimo de energía necesaria para que la reacción pueda ocurrir. Esta energía es llamada entalpía de activación.
Como se observa en la gráfica de arriba, al principio de la reacción A y B se encuentran separados pero acercándose. Si las moléculas tienen suficiente energía la reacción comenzará. El estado de máxima energía en la reacción es en el estado de transición, cuando A y B se hallan formando el estado de transición inestable ( AB ‡). Luego, la gráfica baja a niveles bajos de energía, cuando se produce C.
La velocidad de esta reacción también depende de las concentraciones de A y B, por lo tanto, esta velocidad sería descrita con la siguiente ecuación:
k‡ es una constante de estadística termodinámica, conocida como constante del estado de transición:
kB = Constante de Boltzmann [ 1.381 · 10 -23 J · K -1 ]
T = temperatura absoluta en grados Kelvin [ K ]
h = Constante de Planck [ 6.626 · 10 -34 J · s ]
Además, la concentración del estado de transición [ AB ‡ ] se puede relacionar con las concentraciones de los reactivos A y B ( que se encuentran en seudoequilibrio) mediante la ley de acción de masas
K ‡ = constante de equilibrio termodinámico
Sustituyendo k‡ y [ AB ‡ ] en la ecuación 4, por las ecuaciones 5 y 6 tenemos que:
Observando la ecuación 2, podemos combinarla con la ecuación 7, y obtenemos como resultado la constante k para toda la reacción:
Existe otra expresión para la constante K‡, según la ley de van´t Hoff:
ΔG ‡ es la energía libre de activación, también descrita en función de entropía de activación, entalpía de activación y temperatura:
R = constante universal de los gases= 8.3145 [ J · mol -1 · K -1 ]
ΔG ‡ = energía libre de activación [ kJ · mol -1 ]
ΔS ‡ = entropía de activación [ J · mol -1 · K -1 ]
ΔH ‡ = entalpía de activación [ kJ · mol -1 ]
Combinando las expresiones 9 y 10 y despejando lnK obtenemos:
La ecuación de Eyring resulta de la sustitución de lnK en la ecuación 11 , por la ecuación 8.
La forma lineal de la ecuación de Eyring sería entonces: