Metales de Transición
En la tabla periódica los metales de transición están localizados entre los grupos 2A y 3A (excluyendo estos). Se definen como elementos cuyos átomos correspondientes no poseen un orbital “d” más energético totalmente completo o que son capaces de formar cationes con orbital d incompleto.
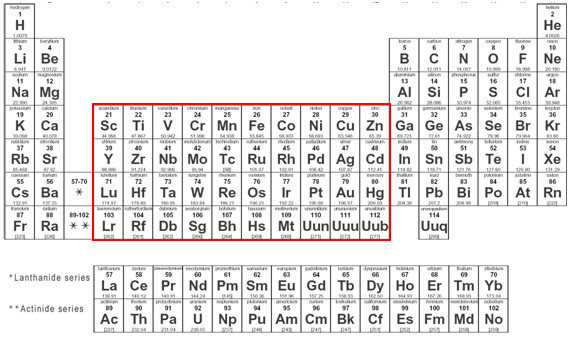
Esta clase de elementos se subdivide en dos: la de los metales de transición externa (constituyendo el bloque d) y la de los metales de transición interna (constituyendo el bloque f). El primer metal de transición (siguiendo orden de número atómico) de la tabla es el Escandio, siendo el último artificialmente producido, el Copernicio (Cn), cuyo isótopo de mayor estabilidad posee una vida media de 29 segundos. Entonces como puede ser visto en la tabla a continuación:
Transicion1.jpg
Características Físicas
La mayoría de los elementos de transición posee características semejantes a la de los otros metales representativos: buena conductividad térmica y eléctrica, brillo (generalmente dorado o plateado) y a pesar de presentar una amplia variación de dureza y puntos de fusión/ebullición (como el Tungsteno, el metal más difícil de cambiar de estado físico que posee un Pf = 3410ºC y Pe = 5660ºC), tienden a ser más duros y poseer mayores Pf y Pe que los metales alcalinos y alcalino térreos, además de conseguir formar enlaces covalentes entre átomos de la misma especie (y no apenas metálicos) por la presencia de orbitales d incompletos.
En relación a la densidad, esta varía desde 2,99g/cm³ del Escandio hasta 22,4g/cm³ del iridio y 22,6g/cm³ do osmio (el metal que presenta los átomos más densos de toda la tabla, debido a sus tamaños y arreglo cristalino cuando están en estado sólido).
Características Químicas
El orden de llenado electrónico en los átomos de metales de transición es de acuerdo con el diagrama de Pauling, primero el orbital s de la 4 capa, para continuar con el orbital 3 de la tercera capa. Por tanto para el primer período la regla general de llenado es 3dn-24s2, donde n corresponde al grupo en el cual el metal está inserto (variando de 3 a 11 – de izquierda a derecha).
En tanto el cobre y el cromo presentan algunas irregularidades: el cobre llena totalmente el orbital d de la tercera capa sin completar el orbital s de la cuarta capa. Al punto que el cromo deja los dos orbitales incompletos, de acuerdo con sus respectivas distribuciones 3d104s1 e 3d54s1; escapando por tanto a la regla.
En los casos del zinc, escandio y otros elementos aún según la definición inicial, también podríamos no considerarlos como metales de transición pues el zinc solo logra formar iones Zn2+, permaneciendo con el orbital d de la tercera capa totalmente competo (de esta forma no se encaja en la condición de formar cationes con orbital d incompleto); así como el escandio al perder tres electrones queda sin ningún orbital d, también no atiende a la condición. Siendo ambos estables de acuerdo con la configuración electrónica del argón (Sc3+).
Buena parte de estos materiales no reacciona fácilmente con gases, en muchos casos debido a la formación de una capa pasiva de óxido o nitrato; al inverso de ello, algunos son utilizados como catalizadores de reacción (como la platina)
Los metales considerados nobles, son aquellos que presentan potencial de reducción positivo (siendo por tanto no susceptibles a oxidar), como el oro, la plata y el paladio. En tanto otros como hierro y cobre, poseen potenciales de reducción negativos (tendiendo a oxidarse). Y a pesar de muchos presentar estado de oxidación variando entre +2 y +4 el Iridio y el Osmio pueden presentar NOx de hasta +8.
