No Metales
Como sabemos los átomos se enlazan unos a otros para completar sus capas de valencia. Recordando, la capa de valencia es la última capa de la electrosfera del átomo y ella se considera completa si posee ocho electrones (para átomos con más de una capa) o dos electrones (para átomos con una única capa).
Así, desde que su capa no esté completa, el se enlazará a otros para intentar completarla.
Un átomo con capa de valencia incompleta se acerca a otro átomo también incompleto y propone una “sociedad electrónica”. Si uno de ellos es más fuerte que el otro, este robará el electrón necesario y no dejará que su “socio” lo comparta. Si esa diferencia de fuerza no fuese tan grande, más allá que uno intente robar al otro, no lograrán ser obligados a compartir el electrón en una sociedad mas “justa”.
La fuerza del átomo
La tendencia o fuerza que un átomo tiene para capturar electrones se llama electronegatividad. Entonces entendemos como fuerte (en este artículo) un átomo que posea gran electronegatividad y como débil a los de baja electronegatividad. El flúor es el más fuerte y el francio el más débil.
Tipos de Enlaces
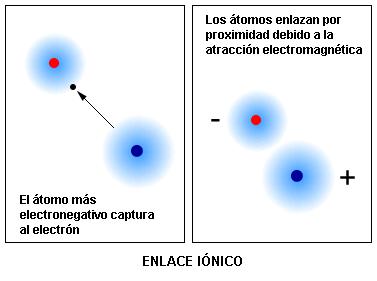
Cuando un átomo fuerte (con gran electronegatividad) se enlaza a un átomo débil (con baja electronegatividad) se presencia una transferencia definitiva de electrón desde el más débil al más fuerte.
Si le quitamos un electrón a un átomo, este deja de ser neutro, por el desequilibrio entre su número de protones y electrones. Cuando un átomo pierde electrones, queda con más protones que electrones y su carga pasa a ser positiva.
Si este átomo gana electrones, también se verá un desequilibrio de cargas y como el tendrá mas electrones que protones, será eléctricamente negativo. Un átomo que deja de ser eléctricamente neutro, volviéndose positivo o negativo comienza a llamarse Ion.
Aproximando un átomo de alta electronegatividad a uno de baja, el captura electrones volviéndose un ion negativo y volviendo al otro electrón un ion positivo.
Como las cargas eléctricas opuestas se atraen, quedarán enlazados por atracción electromagnética y el tipo de enlace es llamado “Enlace Iónico”.
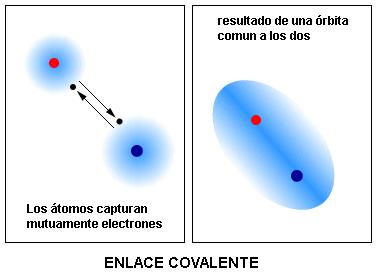
Si aproximamos dos átomos de fuerte electronegatividad, uno no tiene fuerza para capturar el electrón del otro permanentemente. Uno captura el electrón, pero el otro logra obtenerlo de regreso y además toma un electrón extra del “socio”. Este intercambio se repite haciendo que el par de electrones (uno de cada átomo) quede orbitando por los dos átomos.
Es importante percibir que en este caso no hay formación de iones. Este tipo de enlace, donde no hay transferencia definitiva de electrones y si el compartir el par y se llama “Enlace covalente”.
Quien es fuerte y quien es débil
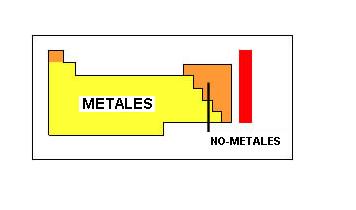
Se consideran fuerte los No-metales y débiles los Metales. Localizando en la Tabla Periódica.
Los No metales se presentan en forma líquida, gaseosa o sólida. Los no metales no son buenos conductores de calor y electricidad y no pueden ser moldeados. Esta última característica se debe al hecho de que, cuando presentes en estado sólido, los no metales se fragmentan, no siendo posible transformarlas en objetos.
Ejemplos:
O2 (Oxígeno molecular) – No metal con un no metal = Enlace Covalente
CO2 (dióxido de carbono) – No metal con un no metal = Enlace Covalente
H2O (Agua) – No metal con un no metal = Enlace Covalente
CH4 (Metano) – No metal con un no metal = Enlace Covalente
Al2O3 (Óxido de Aluminio) – Metal con un No Metal = Enlace Iónico
NaCl (Cloruro de Sodio) – Metal con un No Metal = Enlace Iónico
PbI (Ioduro de Plomo) – Metal con un No Metal = Enlace Iónico
FeS (Sulfato de Hierro) – Metal con un No Metal = Enlace Iónico
¿Existen otros tipos de enlaces?
Si, existen también enlaces metálicas y aún un tipo especial de enlace covalente llamado enlace covalente coordinado.
Resumiendo
Metales con No Metales = Enlace Iónico
No Metales con No Metales = Enlace Covalente
Enlace Iónico = Transferencia definitiva de electrones, formación de iones.
Enlace Covalente = Compartir el par de electrones en órbita común.