Interacción dipolo-dipolo
La interacción dipolo-dipolo es la observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo. En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones. Las atracciones electrostáticas entre dipolos de carga contraria, de diferentes moléculas son las llamadas interacciones dipolo-dipolo.
En la siguiente figura observamos un ejemplo de este tipo de interacción, entre moléculas de ácido clorhídrico.

Otro ejemplo puede ser el de las moléculas de cloruro de bromo. Las interacciones dipolo-dipolo se representan con líneas punteadas.
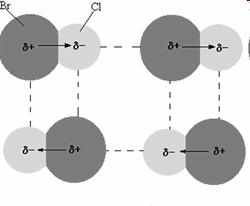
La fuerza de este tipo de interacción es bastante débil, de un promedio de 4 kJ por mol, en comparación con la energía de enlaces covalentes o iónicos. Sin embargo, aunque estas interacciones son débiles en comparación con los enlaces covalentes e iónicos, son fundamentales para determinar las propiedades físicas y químicas de las sustancias, como su solubilidad, punto de fusión y punto de ebullición.
Existen varios tipos de interacción dipolo-dipolo:
Interacción dipolo permanente. Es el que ocurre entre dos moléculas cuyos enlaces son covalentes polares, es decir, que forman dipolos por diferencia de electronegatividad entre sus átomos.
Interacción dipolo inducido. Se produce cuando en moléculas no polares, el dipolo es inducido, por ejemplo mediante un campo eléctrico.
Además de estas interacciones, también existen las interacciones de Van der Waals, que son las fuerzas atractivas entre moléculas no polares. Estas fuerzas son el resultado de la formación de dipolos temporales debido a las fluctuaciones en la distribución electrónica de las moléculas. Aunque son más débiles que las interacciones dipolo-dipolo, pueden ser significativas en moléculas grandes o en situaciones donde las moléculas están muy juntas.
También existen interacciones entre un dipolo permanente y un dipolo inducido. Los iones también son capaces de interaccionar con dipolos de moléculas, ya sean éstos permanentes o inducidos.
La interacción dipolo-dipolo también puede suceder entre dos partes de la misma molécula, si ésta es lo suficientemente grande. Este fenómeno es especialmente relevante en las proteínas, donde las interacciones dipolo-dipolo pueden contribuir a la estabilidad de la estructura tridimensional de la proteína.
En un líquido, por ejemplo, las moléculas están muy cercanas entre sí, unidas por fuerzas intermoleculares, por ejemplo interacciones dipolo-dipolo. Cuanto mayor es la fuerza intermolecular que las une, mayor será el punto de ebullición del líquido, dado que se necesitará más energía para romper dichos enlaces.
Esto es lo que sucede con las moléculas de agua, que están unidas por un tipo especial de interacción dipolo, el puente de hidrógeno. En el puente de hidrógeno el dipolo positivo de este átomo interacciona con el par libre de electrones del átomo de oxígeno.
Estos enlaces dan mayor cohesión a las moléculas y es la razón por la cual el punto de ebullición del agua es mucho más alto del esperado para su peso molecular.
La interacción dipolo-dipolo existe independientemente de otras fuerzas intermoleculares, como las fuerzas de dispersión de London, donde los movimientos de las moléculas causan dipolos temporarios que ejercen fuerzas de atracción electrostática temporarias también.
