Enlace de hidrógeno
Los enlaces de hidrógeno, también conocidos como, enlaces por puente de hidrógeno, son un tipo de enlace que se encuentra dentro de las fuerzas intermoleculares, que son un tipo de fuerzas de atracción que existen entre las moléculas de las sustancias de carácter covalente, siendo el enlace de hidrógeno, un tipo particular de interacción electrostática dipolo-dipolo, que se da entre un átomo de hidrógeno, que se encuentra formado por un enlace covalente altamente polarizado, y un átomo de tamaño pequeño, con un carácter fuertemente electronegativo, como pueden ser el F, O y el N.
Se puede decir que el enlace de hidrógeno, es una fuerza de Van der Waals dipolo-dipolo, pero de carácter muy fuerte, pero aún más débil de lo que pueden ser un enlace covalente o iónicos normales.
Las energías medias del enlace de hidrógeno son bajas, por ejemplo, en el agua, el O-H, posee una energía de enlace intermolecular en torno a 20 KJ.mol^-1, en cambio la del enlace covalente del O-H, es de unos 460 KJ. mol^-1. Sin embargo, éstas son bastante más altas, de lo que lo son en las interacciones dipolo-dipolo normales, explicándose esto en que las sustancias que tienen enlaces de hidrógeno poseen puntos de fusión y ebullición anormalmente elevados.
El punto de ebullición del agua, es tan elevado, debido a que teniendo en cuenta su estructura, vemos que cada átomo forma un enlace de hidrógeno, a la vez que cada átomo de oxígeno, debido a tener dos pares de electrones que se encuentran no enlazados, participan en otros muchos enlaces de hidrógeno. De este modo, la molécula de agua, H2O, se encuentra unida de manera muy estable, y de forma tetraédrica a cuatro moléculas que se encuentran próximas.
El caso del agua, es quizás el más fácil, en cuanto a enlaces de hidrógeno se refiere, pues ésta se encuentra formada por dos átomos de hidrógeno y uno de oxígeno, pudiendo entonces, dos moléculas de agua, formar un enlace de hidrógeno entre ellas, conociéndose como dímero de agua. Este hecho puede repetirse de igual forma, hasta con cuatro moléculas de agua, dos a través de los pares libres, y otras dos gracias a los átomos de hidrógeno.
Si las moléculas de agua se encontrasen unidas por fuerzas de Van de Waals, en vez, enlaces de hidrógeno, el agua, tal y como la conocemos, a temperatura ambiente sería un gas.
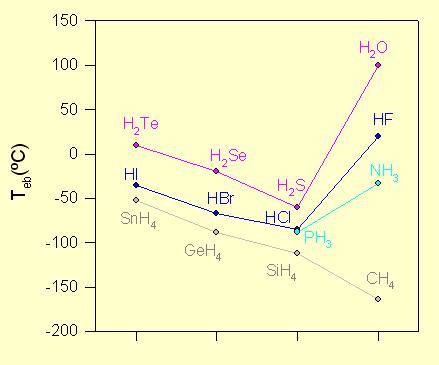
Los hidruros covalentes simples, tienen existencia como moléculas aisladas, existiendo entre ellas, las fuerzas de cohesión de tipo Van de Waals, lo que las hace ser muy débiles, menos en los casos del: H2O, NH3, y el HF. Esto se explica gracias a los valores de los puntos de fusión y ebullición, así como también los calores de vaporización.
Los hidruros de los grupos IV, V y VII, nos sirven de referencia, ya que éstos muestran una variación bastante continua, cumpliéndose en general, que a medida que aumenta el peso molecular del elemento, los puntos de fusión-ebullición y los calores de vaporización, también aumentan, sin embargo, se ve claramente, que en los casos del H2O, NH3 y HF, esto no se cumple, pues son bastante más altos los valores, que en el resto de las moléculas, siendo los pesos moleculares son 18, 17, y 20 gr/mol, respectivamente.
De este hecho podemos deducir, que existen existen unas fuerzas intermoleculares mucho más intensas, es decir, los enlaces de hidrógeno, los cuales son de tipo H^δ+….H^δ-, donde el elemento X, es fuertemente electronegativo, ya que posee pares de electrones solitarios.
En general, si tomamos como referencia los compuestos anteriormente mencionados, H2O, NH3 y HF, podemos concluir que, según aumenta el número de enlaces de hidrógeno, H-O, N-H y H-F, aumentarán también los puntos de fusión-ebullición y los calores de vaporización, aunque los valores de los pesos moleculares no sea excesivamente notoria.
Los enlaces de hidrógeno, tienen lugar tanto en moléculas inorgánicas, como puede ser el agua, o en moléculas orgánicas, como puede ser el ADN.