Enlaces Intermoleculares
Interacciones dipolo – dipolo
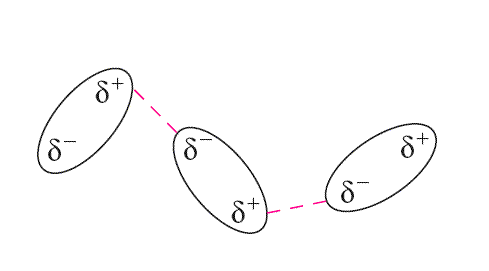 Ocurren entre moléculas polares. La extremidad negativa de una molécula es la extremidad positiva de otra molécula, vecina a ella, se atraen mutuamente. Esas interacciones son también llamadas interacciones bipolares
Ocurren entre moléculas polares. La extremidad negativa de una molécula es la extremidad positiva de otra molécula, vecina a ella, se atraen mutuamente. Esas interacciones son también llamadas interacciones bipolares
Enlaces de Hidrógeno
Cuando en una molécula, existiese hidrógeno enlazado a un átomo pequeño y muy electronegativo (F, O, N), habrá una gran polarización de ese enlace, lo que producirá en el hidrógeno un intenso polo positivo. Esa polarización lleva al hidrógeno a interactuar con el par de electrones de otra molécula vecina, resultando en una interacción entre las moléculas, el enlace de hidrógeno (que algunos denominan puente de hidrógeno), mas fuerte que la del tipo dipolo-dipolo.
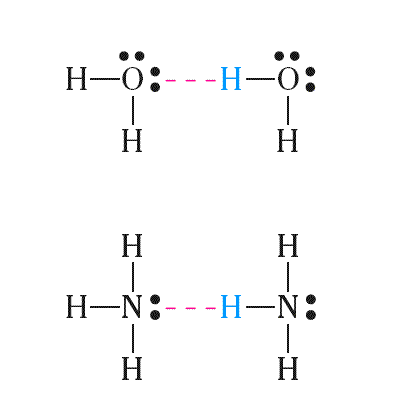
Ejemplos de sustancias que presentan enlaces de hidrógeno son el agua (H2O), el fluoruro de hidrógeno (HF), el amonio (NH3), los alcoholes (ROH), los ácidos carboxílicos (RCOOH), las amidas con H enlazado al N (RCONH2) y las aminas primarias (RNH2) y secundarias (RR´NH).
Interacciones dipolo instantáneo-dipolo inducido
Se deben a fluctuaciones de la nube electrónica, que crea dipolos instantáneos y en el decorrer de ellos, dipolos inducidos en las moléculas vecinas.
Ocurren en todas las moléculas, polares o apolares, pero son particularmente relevantes en las moléculas apolares, en que no ocurren los tipos citados anteriormente.
Son también denominadas fuerzas dipolo inducido – dipolo inducido o fuerzas de dispersión de London. Algunos autores las llaman de fuerzas de Van der Waals. Con todo, otros autores usan la expresión fuerzas de Van del Waals como sinónimo de las fuerzas intermoleculares de modo general.

Fuerzas Intermoleculares y punto de ebullición
Cuando una sustancia molecular pasa de la fase líquida (o sólida) para la fase gaseosa, ocurre el rompimiento de los enlaces intermoleculares.
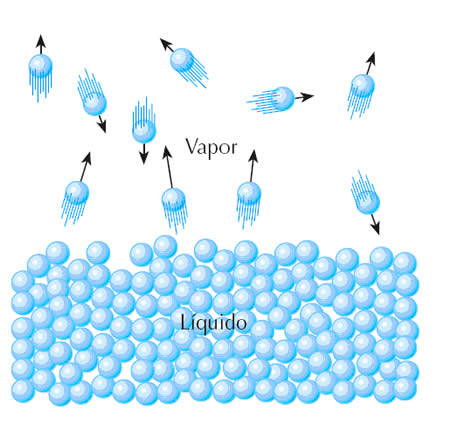 Al comparar dos sustancias con el mismo tipo de interacción intermolecular, se espera que la que tuviese mayor tamaño (estimado generalmente, por la masa molecular o por el tamaño de la cadena carbónica) presenta mayor punto de ebullición.
Al comparar dos sustancias con el mismo tipo de interacción intermolecular, se espera que la que tuviese mayor tamaño (estimado generalmente, por la masa molecular o por el tamaño de la cadena carbónica) presenta mayor punto de ebullición.
Al comparar dos sustancias con masas moleculares y tamaños aproximadamente iguales, se espera que la que poseyese fuerzas intermoleculares más intensas presente mayor punto de ebullición.
