Las valencias
Las valencias, también nominadas como número de valencia, son en el campo de la química una forma de medida para las cantidades de enlaces químicos que forman diferentes átomos de cada elemento químico. Con el tiempo, y a lo largo del siglo XX, el concepto de valencia ha sufrido una evolución con lo cual se ha conseguido ir describiendo con mayor exactitud el concepto de enlace químico, como por ejemplo la estructura de Lewis en el año 1916, la teoría de los orbitales moleculares, en el año 1928, así como los métodos de la química cuántica, etc.
El origen del nombre de “valencia”, procede del latín “valentia”, que tienen significados como fuerza y capacidad, preparación o extracto. En el campo de la química hace referencia al poder de combinación que posee un elemento, concepto que se encuentra registrado desde el año 1884.
Ya por el año 1789, se publicaron los primeros dibujos sobre combinaciones de las que se conocían como últimas partículas. Dichos dibujos fueron realizados en primer lugar por William Higgins, y en ellos se hacía referencia al concepto de los enlaces de valencia. Higgins ponía como ejemplo la fuerza que se provocaba entre la última partícula del oxígeno y la última del nitrógeno, siendo esta de valor 6, por lo que la fuerza de enlace entre ellos debería ser dividida, siendo símil a otras combinaciones que se pudiesen producir entre otras últimas partículas.
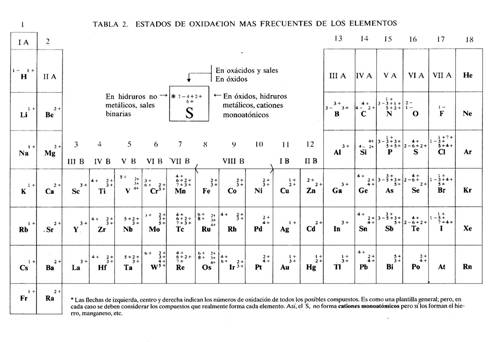
Existen diferentes tipos de valencias, por un lado encontramos la valencia positiva máxima, siendo un número positivo que hace referencia a la capacidad máxima que posee el átomo para combinarse. Dicho número coincide con el grupo al cual pertenece dentro de la tabla periódica de los elementos químicos. Como ejemplo podemos poner el cloro, el cual pertenece al grupo VII de la tabla periódica y por lo tanto su valencia positiva (máxima) es igual a 7.
En cuanto a las valencias negativas, estas hacen reflejo a la capacidad que posee el átomo de poder combinarse con otro como en el caso anterior. Dicho número negativo puede hallarse contando lo que le falta a la valencia positiva máxima para llegar al número 8, pero siempre con signo negativo. Por ejemplo, siguiendo con el caso del cloro, su valencia máxima positiva es de 7, y si le restamos 8, nos dará -1, siendo precisamente este número negativo la valencia máxima negativa para este elemento.
Resumiendo podemos decir que el concepto de valencia fue desarrollado a finales del siglo XIX, cuando se intentaba hacer más racional el tema de las fórmulas químicas de los diferentes compuestos químicos. Fue en 1919, cuando Irving Langmuir, cogió el término de valencia para poder explicar el modelo de átomo cúbico de Lewis, al enunciarse que el número de electrones pares que puede tener cualquier átomo al compartir con el átomo que se encuentra a su lado se conoce como covalencia del átomo. El prefijo “co-” de covalencia, significa “junto”, por lo que un enlace co-valente quiere decir que los átomos comparten valencia. Así por ejemplo, si un átomo posee la valencia +1, quiere decir que éste perdió un electrón, y otro átomo, con una valencia -1, quiere decir que tienen un electrón más. Por lo que un enlace que se forma entre dos átomos se produce porque estos se complementan o comparten sus tendencias del balance de las valencias. Por lo tanto, es más correcto hablar de enlaces covalentes, en vez de usar la palabra valencia simplemente, pues este último término se encuentra en desuso debido a los adelantes dentro del campo de los enlaces químicos, aunque claramente es muy usado comúnmente sobre todo en los cursos elementales de química.
Para definir el número de enlaces se creía principalmente que los números de enlaces que se constituyen era una propiedad fija en la química, como por ejemplo en muchos compuestos del carbono, este forma cuatro enlaces, el hidrógeno uno sólo, y el oxígeno dos. Pero para el caso de muchos elementos, las valencias solían variar en depende que compuestos. Uno de los elementos en el que se identificó este hecho, fue el fósforo, el cual a veces se comportaba como si su valencia fuese tres, y otras veces comosi fuese cinco. Para resolver dicho problema, se emplea el método que consiste en especificar la valencia concretamente para cada compuesto de forma individual, lo que hace que el término ya no sea una cosa general, lo que ha hecho dar paso a otro concepto, el “ número de oxidación”.
La IUPAC (Unión Internacional de Química Pura y Aplicada), tras muchos intentos de dar una definición única, adoptó en 1994 la siguiente:
“el máximo números de átomos univalentes que puede combinarse con un átomo del elemento en consideración, o un fragmento, o para el cual un átomo de este elemento puede ser sustituido”.
La gran mayoría de las valencias de los distintos elementos, se basan en el fluoruro más alto que se conoce.