Zwitterion
El término proteína significa “aquel que mantiene el primer lugar”, pues son las macromoléculas con las mayores diversidades de funciones biológicas para el mantenimiento de las células.
Las proteínas son formadas por la unión de varios aminoácidos (monómeros) a través de enlaces peptídicos. El número de aminoácidos que forma una proteína gira en torno de 100 a 1800 aminoácidos.
Millares de diferentes tipos de proteínas pueden ser encontradas en una única célula. Estas proteínas diferentes exhiben una gran diversidad de funciones biológicas. Algunas actividades biológicas importantes de las proteínas son:
Estructural: algunas estructuras de los animales, tales como piel, huesos, cabello y uñas son constituidas principalmente por proteínas estructurales, siendo el colágeno y la queratina;
Catálisis: Virtualmente todas las reacciones que suceden en los organismos vivos son catalizadas por proteínas conocidas como enzimas. Sin las enzimas las reacciones sucederían tan lentamente que se volverían innecesarias.
Movimiento: A toda hora, en cualquier actividad que realicemos, mientras utilizamos los músculos, su expansión y contracción están involucradas en cada movimiento que realizamos. Los músculos son realizados por moléculas de proteínas llamadas miosina y actina.
Hormonas: Muchas hormonas son proteínas, se destacan la insulina y la hormona humana del crecimiento.
Transporte: Muchas proteínas se encajan en esta categoría. Hemoglobina, la proteína de la sangre, carga oxígeno de los pulmones hacia las células y el dióxido de carbono de las células hacia los pulmones. Otras proteínas transportan moléculas a través de las membranas celulares.
Protección: cuando una sustancia extraña (llamada antígeno) entra en un organismo, este organismo produce algunas proteínas (anticuerpos) para contra atacar la sustancia extraña. Este es el principal mecanismo que el organismo utiliza para combatir enfermedades.
La coagulación de la sangre es otro mecanismo realizado por proteínas conocidas como fibrinógeno. Sin la coagulación de la sangre, a partir de una simple herida, tendríamos una hemorragia hasta morir.
Almacenamiento: algunas proteínas son direccionadas para ser almacenadas, de la misma forma que el almidón y el glicógeno almacena energía.
Ejemplos son la caseína presente en la leche y la ovoalbúmina en los huevos, las cuales estoquean nutrientes para los mamíferos recién nacidos y pajaros. Ferritina, una proteína del hígado que almacena hierro.
Regulación: Algunas proteínas controlan la expresión de genes y por tanto regulan y controlan cuando una síntesis proteica debe suceder en la célula.
Estas no son las únicas funciones de las proteínas, pero ellas son las más importantes.
Aminoácidos
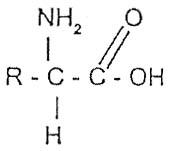
Los aminoácidos poseen en común un grupo carboxili o ácido (COOH) y un grupo amina ó ácido (NH2), ligado al mismo carbono, diferenciando uno de otro por el radical que poseen, como vemos a continuación:
Características químicas
Los aminoácidos son compuestos formadores de las proteínas. Ellas se forman por la condensación de muchas moléculas de aminoácidos. Debemos aclarar que los aminoácidos formadores de las proteínas son siempre alfaaminoácidos (MH2 ligado en el carbono vecino de la carboxila).
Carácter Anfótero
Los aminoácidos presentan carácter anfótero, ya que pueden reaccionar con las bases, a través de su grupo ácido (COOH) y con los ácidos, a través de su grupo básico (NH2).
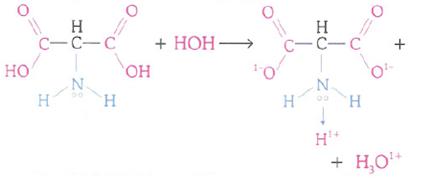
Tal hecho posibilita que un aminoácido en solución acuosa, reaccione con el mismo, originando una sal interna conocida como Zwitterion.
Una vez que ácidos y bases se neutralizan formando sal, en un aminoácido ocurrirá una neutralización intramolecular, formando una sal interna que en verdad es un ión dipolar denominado zwitteríon.
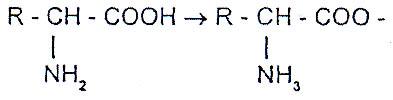
Reacción del ión zwitteríon con un ácido, por ejemplo el HCl (aq):
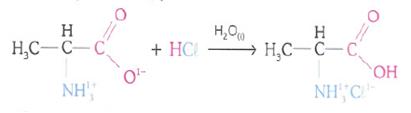
Reacción del ión zwitteríon con una base, por ejemplo el NaOH(aq):
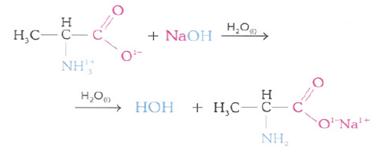
Clasificación del Ión Zwitteríon
Por presentar una estructura de sal, estos iones son solubles en agua. Una vez en solución acuosa, podemos clasificar un ión zwitteríon como neutro, positivo o negativo.
Zwitteríon neutro (o aminoácido neutro): Es aquel que posee el mismo número de grupos Carboxila y amina. Las cargas internas se cancelan si la solución permanece neutra.
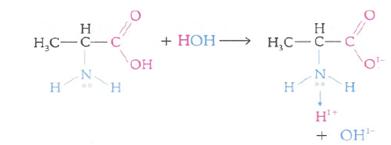
Zwitteríon positivo (o aminoácido básico): Es aquel que posee un número mayor de grupos amina en relación a los grupos carboxila. El ión queda con exceso de carga positiva, sucede liberación de iones hidroxilo, OH 1-, y la solución se vuelve básica.
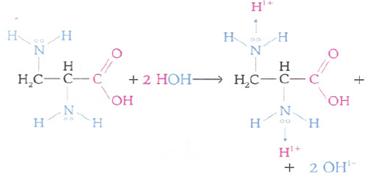
Zwiterión negativo (o aminoácido ácido): Es aquel que posee un número mayor de grupos carboxilo en relación a los grupos amina. El ión queda con exceso de carga negativa, sucede la liberación de iones hidronio, H3O 1+ y la solución se vuelve ácida.