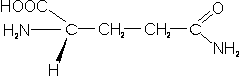Cadena lateral en aminoácidos
Los aminoácidos son ácidos orgánicos, que se combinan para formar proteínas. La estructura básica de un aminoácido esta compuesta por un carbono central (alfa), unido a un grupo carboxilo (COOH), un grupo amino (NH2), un hidrógeno y una cadena lateral R, que es la que distingue un aminoácido de otro.
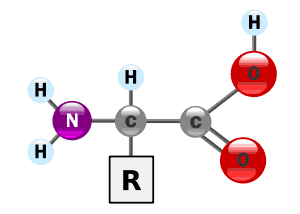
Si el aminoácido se encuentra en solución acuosa y pH 7, los grupos carboxilo y amino se ionizarán, es decir, el hidrógeno del grupo carboxilo pasa al grupo amino, y como consecuencia se formará un dipolo en la molécula.
Como ya dijimos, los aminoácidos se diferencian unos de otros por su cadena lateral R. Según los componentes de esta cadena, podemos clasificar los aminoácidos de la siguiente manera:
Aminoácidos alifáticos
La cadena lateral de estos aminoácidos es hidrofóbica, por eso tienden a ubicarse en el interior de las proteínas globulares, al encontrarse en solución acuosa.
– Glicina (Gly; G):. Tiene como cadena lateral sólo un átomo de hidrógeno. Es el aminoácido más simple de todos.
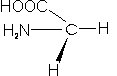
– Alanina (Ala; A): En su cadena lateral encontramos un grupo metilo.

– Valina (Val; V): Es más hidrofóbica que las anteriores, dada su cadena lateral hidrocarbonada más larga y ramificada.
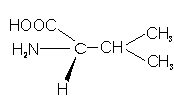
– Leucina (Leu; L): parecida a la anterior, con un grupo metilo más.
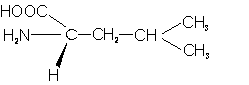
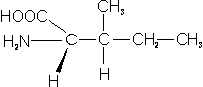
– Isoleucina (Ile; I): Se diferencia de la leucina por la posición de uno de los grupos metilo..
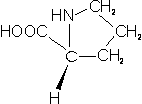
– Prolina (Pro; P): su cadena lateral se une al carbono central y además al grupo amino, formando un anillo.
Aminoácidos aromáticos
En la cadena lateral de estos aminoácidos encontramos un anillo aromático. Esta es la razón de que sean altamente hidrofóbicos.
– Fenilalanina (Phe; F): su cadena lateral está compuesta por un grupo metilo y un anillo bencénico en el extremo.
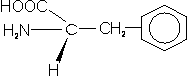
– Tirosina (Tyr; Y): igual que la anterior pero con un grupo hidroxilo al final, lo que lo confiere cierta hidrofilia.
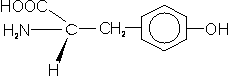
– Triptófano (Trp; W): observamos un anillo indol entre el anillo bencénico y el grupo metilo. Altamente hidrofóbico.
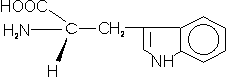
Aminoácidos sulfurados
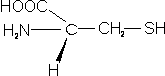
– Cisteína (Cys; C): en su cadena lateral encontramos un grupo sulfhidrilo (-SH). Este grupo es muy reactivo y forma puentes de hidógeno y enlaces disulfuro (S-S; enlace covalente)
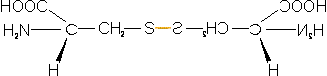
En la imagen de arriba observamos dos cisteínas unidas por enlace disulfuro, el aminoácido resultante es llamado cistina.
– Metionina (Met; M): Todos los procesos de transcripción de proteínas comienzan con este aminoácido. Su grupo sulfhidrilo no es tan reactivo como en los aminoácidos anteriores.
Aminoácidos hidrófilos
En este grupo podemos encontrar tres subgrupos: aminoácidos ácidos, básicos y neutros.
Aminoácidos ácidos: son muy polares y gracias al grupo ácido que podemos encontrar en su cadena lateral, tienen carga negativa a pH neutro.
– Ácido aspártico (Asp; D): también llamado aspartato, porque a pH fisiológico se encuentra disociado, ya que el grupo carboxilo pierde el hidrógeno.
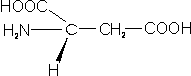
– Ácido glutámico (Glu; E): también conocido con el nombre de glutamato, por la misma razón que el anterior.
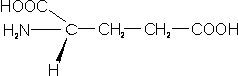
Aminoácidos básicos: en sus cadenas laterales encontramos grupos amino, que se cargarán positivamente a pH neutro.
– Lisina (Lys; K): Su cadena lateral es larga. Aunque podría parecer una cadena hidrofóbica, la polaridad está dada por el grupo amino terminal.
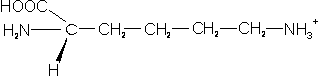
– Arginina (Arg; R): contiene la cadena lateral más larga de todas, con un grupo guanidino en el extremo.
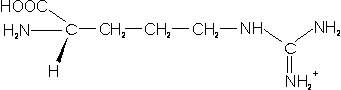
Aminoácidos neutros: no encontramos grupos amino ni grupos carboxilo en su cadena R, por lo tanto no tienen carga a pH neutro. Sin embargo son polares, y pueden formar puentes de hidrógeno.
– Serina (Ser; S): Tiene un grupo OH al final de su cadena R.
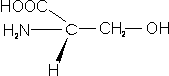
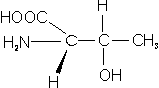
– Treonina (Thr; T): También tiene un Grupo OH en su cadena R.
– Glutamina (Gln; Q): tiene un grupo amino y un carbonilo en el extremo de su cadena.