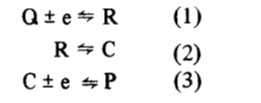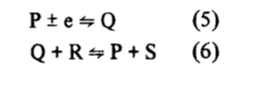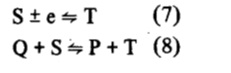Transferencia Electrónica – Mecanismo ECE
En los procesos electroquímicos son frecuentes los ejemplos de mecanismos que están involucradas, etapas de transferencias de más de un electrón o una o más especies que participan del conjunto global de reacciones. Sin embargo, son bastante raros los casos donde está demostrada la transferencia simultánea de más de un electrón para una misma especie que participa de un determinado mecanismo.
En particular en electroquímica orgánica se ha observado que la transferencia simultánea de dos electrones hacia una misma molécula resulta bastante improbable debido a la repulsión electrónica, la cual no puede ser compensada por un simple aumento de la solvatación.
De esta forma, en la mayoría de los casos donde más de un electrón está involucrado en el proceso electroquímico, reacciones químicas están normalmente intercaladas entre las varias etapas de transferencia electrónica.
En este contexto, el concepto de mecanismo ECE (del inglés Electrochemical, Chemical, Electrochemical) ha sido muy útil para explicar por qué los procesos de reducción u oxidación multielectrónicos han sido tan frecuentemente encontrados en electroquímica. Genéricamente en este mecanismo, el producto de una primer reacción de transferencia electrónica, está involucrado en una reacción química, formando un compuesto más fácil de reducir (u oxidar) que la especie inicial y llevando a una aparente transferencia electrónica simultánea de dos electrones.
En tanto en los últimos años, la segunda reacción de transferencia electrónica de ese mecanismo ECE (reacción 3) ha sido postulada también como posible en fase homogénea, a través de una reacción del tipo
Así la secuencia de reacciones (1) (2) (3), correspondiente al clásico mecanismo ECE, ha sido substituida por la secuencia (1) (2) y (4), que constituye un mecanismo de desproporción (DISP) desde que R y C están en un mismo estado de oxidación.
Los mecanismos redox de catálisis homogénea son un segundo ejemplo en que la aparente transferencia simultánea de varios electrones es explicada con base en la interpretación de reacciones homogéneas.
En este caso el producto de una reacción de electrodo está implicado en una reacción de transferencia de electrones homogéneo en la cual, el electrón recibido (o transferido) del electrodo se transfiere (o recibe) para un tercer componente del sistema.
La especie P es regenerada en las cercanías del electrodo, resultando en un ciclo catalítico en que la especie Q actúa como un puente de transferencia de electrones desde el electrodo hacia la especie R y viceversa. El número total de electrones que es transferido en el ciclo, será el resultado de la suma de las varias etapas individuales, pudiendo alcanzar valores del orden de 20, dependiendo de la magnitud de la constante de velocidad de la reacción (6) y de la concentración de la especie R.
Por otra parte, particularmente en sistemas que involucran substancias orgánicas, la especie S es electroquímicamente inestable y puede ser reducida (u oxidada) en la superficie del electrodo y o en solución
De esta forma también el mecanismo redox de catálisis homogénea se inserta en la problemática ya discutida en el mecanismo ECE, en que una reacción de transferencia electrónica heterogénea (reacción 7) puede competir con una reacción equivalente en solución (reacción 8), ambas llevando al mismo producto final (especie T).
Los dos ejemplos mencionados, que presentan una competición entre una reacción homogénea con una heterogénea han sido intensamente estudiados para varios tipos de sistemas experimentales particularmente en electroquímica orgánica.
Así, dentro de la problemática ECE/DISP los siguientes tipos de reacciones ya fueron estudiadas: la electrohidrogenación de compuestos aromáticos, la carboxilación reductiva de compuestos orgánicos insaturados, el clivaje reductivo de haluros de arilo, etc.
Por otra parte, en los procesos redox de catálisis homogénea, los sistemas experimentales más comúnmente estudiados son la reducción de haluros orgánicos por radicales aniones aromáticos, la reducción de triorganohalogermanios por 9,10 – difenilantraceno y antraceno, la reducción de difenil-sulfato por terfenilo, etc.