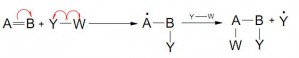Mecanismo de Reacción
La descripción detallada de una reacción química paso a paso es el mecanismo de reacción, los mecanismos de reacción están ligados a la cinética química:
- Que enlaces son rotos?
- En que orden?
- Cuantas etapas están involucradas?
- Cual es la velocidad de cada etapa?
Un mecanismo no puede ser probado, el debe satisfacer todos los hechos experimentales y puede ser anulado con la aparición de nuevos hechos.
Existen reacciones que suceden por mecanismos diferentes bajo diferentes condiciones.
Existen también casos donde más de un mecanismo es capaz de describir todos los hechos experimentales.
Tipos de mecanismos
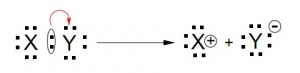
a) Mecanismo Heterolítico
Para la mayoría de las reacciones es conveniente denominar los reactivos como:
- Reactivo atacante
- Sustrato
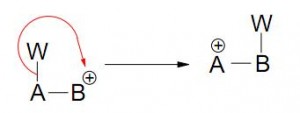
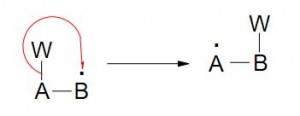
Reactivo: Puede “traer” el par de electrones hacia el sustrato (nucleófilo) o “tomar” un par de electrones de el (electrófilo)
- Reacción nucleofílica – (Reactivo nucleofilo)
- Reacción electrofílica – (Reactivo electrófilo)
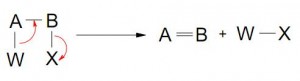
Cuando la molécula del sustrato se rompe:
- La parte que no contienen carbono es el grupo que “abandona” (nucleófilo o electrófilo)
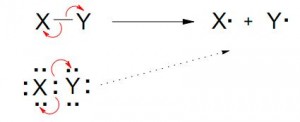
b) Mecanismo Homolítico (A través de radicales libres)
c) Mecanismo Pericíclico
Los electrones se trasladan sin la formación de iones o radicales
Tipos de Reacción:
La mayoría de las reacciones pueden ser encuadradas en una de las seis categorías:
i- SUSTITUCIONES (3 posibilidades)
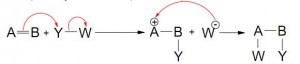
- Nucleofílica (Heterolítica)
Atrae el par de electrones hacia el sustrato
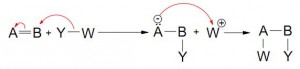
- Eletrofílica (Heterolítica)
Toma su par de electrones desde el sustrato
- Vía radicales libres (Homolítica)
Transferencia de cadena
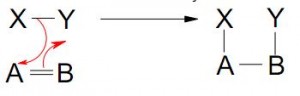
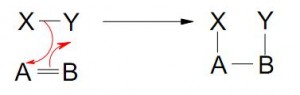
ii- ADICIONES A DOBLES O TRIPLES ENLACES ( 4 posibilidades)
- Adición electrofílica (Heterolítica)
- Adición nucleofílica (Heterolítica)
- Adición a través de radicales libres (Homolítica)
- Adición Simultánea
La mayor parte de los esquemas muestra Y-W rompiéndose al mismo tiempo en que Y se enlaza a B. Esto raramente sucede, a no ser en el caso de reacciones pericíclicas.
iii- ELIMINACIÓN BETA (β)
Estas reacciones pueden suceder por mecanismo heterolítico o pericíclico (vía radicales libres son raras).
- W y X pueden salir o no de forma simultánea
- Pueden combinarse o no
iv- REORDENAMIENTOS
Pueden involucrar migración de 1 átomo o grupo de un átomo hacia otro.
- Migración con 1 par de electrones (nucleofílica)
- Migración con 1 electrón (radical libre)
Los esquemas muestran reordenamientos del tipo en que el migrante se mueve hacia el átomo vecino (más comunes). Sin embargo, pueden suceder también reordenamientos para átomos más distantes.
Existen reordenamientos que no involucran migraciones simples. Algunos involucran mecanismos pericíclicos.
v- OXIDACIÓN Y REDUCCIÓN
Muchas reacciones de oxidación y reducción encuadran en uno de los cuatro tipos ya citados y muchas otras no.
i- COMBINACIÓN DE LOS TIPOS YA CITADOS
OBSERVACIONES:
Las flechas utilizadas son empleadas para mostrar el movimiento de los electrones. Más allá que sean utilizadas en reacciones pericíclicas por comodidad, no se sabe realmente en que dirección los electrones se están moviendo.
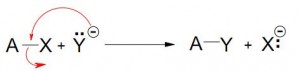
SUSTITUCIÓN NUCLEOFÍLICA
Las reacciones de sustitución se constituyen en uno de los tipos más comunes entre los encontrados en la química orgánica.
Sustituciones nucleofílicas en el carbono saturado
Los más comunes son los mecanismos SN1 y SN2
Difieren entre si en el proceso de formación de un nuevo enlace y rutpura del anterior.
Mecanismo SN2 (Mecanismo de 1 etapa)
El nucleofilo atacante se aproxima del sustrato a 180 grados del grupo de salida
- En el ET (estado de transición) Y y X están parciamente mezclados con el orbital p, aproximadamente en posición perpendicular al orbital sp2.
- En el ET los 3 sustituyentes y el C central son aproximadamente coplanarios.
Existen muchas evidencias experimentales para este mecanismo.
La formación de un nuevo enlace ocurre simultáneamente con la rotura del antiguo.