Ión Monoatómico – Configuración electrónica del átomo
La configuración electrónica es la forma en que los electrones se distribuyen alrededor del núcleo de un átomo, distribución que se refleja en diferencias de energía.
La energía de un electrón es definida por los llamados números cuánticos, que tienen origen en la química cuántica de Schöedinger.
El número cuántico n, o número cuántico principal, define la mayor parte de la energía de un electrón, relativa a su proximidad del núcleo.
El conjunto de electrones que se encuentra a la misma distancia del núcleo es llamado nivel n; a cada conjunto o nivel, son atribuidos valores enteros.
El número cuántico I, o secundario, indica las pequeñas diferencias de energía entre electrones del mismo nivel y puede tener valores enteros (de 0, 1, 2, hasta n-1)
Las pequeñas diferencias de energía son atribuidas a las formas que un orbital asume. Los electrones con el mismo n e I forman un subnivel.
Hay dos números cuánticos más: el magnético, m, que puede asumir los valores enteros negativos o positivos (-1 ó +1) e indica la orientación del orbital en el espacio y el spin s, con valor + ½ o – ½, que se refiere al sentido de rotación del electrón en torno de si mismo.
La configuración electrónica revela los electrones de mayor energía de un átomo, que, junto con los electrones del último nivel, son los responsables por sus propiedades.
Ión Monoatómico
Un ión es una especie química eléctricamente cargada, generalmente un átomo o molécula que perdió o ganó electrones. Iones cargados negativamente son conocidos como aniones (que son atraídos por átomos) en tanto que los iones con carga positiva, son denominados cationes (atraídos por cátodos).
Cuando se utiliza el término “ión monoatómico” esto quiere decir que se trata de un ión formado por un único átomo, o sea, un átomo que por haber perdido o ganado electrones, pasa a tener carga ya qe un elemento en su estado fundamental posee carga nula.
Si ganó un electrón su carga es -1, si perdió un electrón su carga es +1.
Es fácil concluir entonces que la carga del electrón es negativa y vale -1.
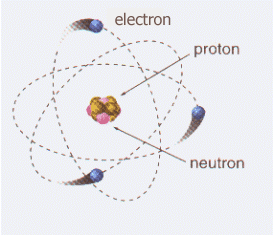
Lo que provoca que un átomo de un elemento tenga carga nula en su estado fundamental, es la presencia de protones en su núcleo. Esas partículas positivas, que están en la misma cantidad que los electrones, se contraponen a estos y anulan sus cargas.
Por ejemplo: Un átomo “X” con 10 electrones y 10 protones posee carga nula, pues 10 electrones = – 10 y 10 protones = +10, así se tiene que -10+10 = 0
Un ión “x” con 10 electrones y 7 protones posee carga igual a – 3, porque 10 electrones son igual a – 10 y los 7 protones = +7, entonces -10+7= -3
Es importante recordar la presencia de una partícula adicional en el átomo, más específicamente su núcleo, donde junto a los protones están los neutrones.
Estos poseen cargas nulas y sumadas sus masas con las de los protones se obtiene la masa del átomo, conocida como número de masa.
