Ácido nítrico
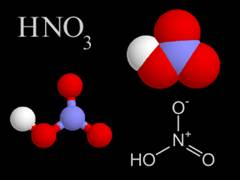 El ácido nítrico, es un compuesto químico líquido de tipo aceitoso, e incoloro cuando se encuentra en estado puro, y es bastante peligroso. Además de ácido nítrico, se le conoce con otros nombres como, ácido trioxonítrico (V), trioxonitrato(V) de hidrógeno, ácido azoico, agua fuerte, espíritu de sal, etc.
El ácido nítrico, es un compuesto químico líquido de tipo aceitoso, e incoloro cuando se encuentra en estado puro, y es bastante peligroso. Además de ácido nítrico, se le conoce con otros nombres como, ácido trioxonítrico (V), trioxonitrato(V) de hidrógeno, ácido azoico, agua fuerte, espíritu de sal, etc.
Suele tener gran utilidad en los laboratorios como agente reactante, además de se usado en la industria de explosivos tan conocidos como la nitroglicerina o el TNT. También participa en la fábrica de fertilizantes, como por ejemplo el nitrato de amonio. Y cabe destacar que es un componente de la peligrosa lluvia ácida.
Todos sabemos que puede ser peligroso como ácido, pero también es un agente oxidante bastante potente y muy fuerte, por lo que es un peligroso potencialmente cuando se encuentra en presencia de cualquier material de tipo oxidante. Cuando se trata como ácido, éste funde a una temperatura de -42ºC, y entra en ebullición a unos +83ºC, teniendo generalmente un ligero color amarillento que es causa de una reacción de descomposición que ha sido inducida por la luz:
4 HNO3 (ac) → 4 NO2 (g) + O2 (g) + 2 H2O (l)
Cuando está en estado puro, el ácido nítrico líquido, no conduce la electricidad prácticamente. Una pequeña parte de él, se ioniza como se indica a continuación:
2 HNO3 (l) ↔ H2NO3^ + NO3^-
H2NO3^+ ↔ H2O + NO2^+
H2O + HNO3 ↔ H3O^+ + NO3^-
Dando la reacción global: 3 HNO3 ↔ NO2^+ H3O^+ + 2 NO3^-
El catión nitrilo tiene gran importancia en la nitración de diferentes moléculas orgánicas, como por ejemplo, la conversión del benceno (C6H6), en nitrobenceno (C6H5NO2), siendo ésta una etapa importante en muchos de los procesos industriales dentro de la química orgánica.
Cuando el ácido nítrico es concentrado, hablamos realmente de una solución al 70% de agua, en cambio, el conocido como “ácido nítrico fumante”, es un poderoso y potente óxido, siendo una solución de color roja de dióxido de nitrógeno en ácido nítrico puro. También incluso cuando se encuentra diluido, el ácido nítrico es tan fuerte como oxidante, que es rara la vez que desprende hidrógeno al contacto con metales; en cambio, se provoca una mezcla de óxidos del nitrógeno y los metales se oxidan a sus cationes.
Los enlaces de O-N terminales, son bastante más cortos, con una longitud de 121 pm, que el enlace O-N que se une a un átomo de hidrógeno, con una longitud de 141 pm. Dicha longitud de enlace nos hace ver que existen múltiples enlaces entre el nitrógeno y los dos átomos de oxígeno terminales.
En cuanto a su síntesis, el ácido nítrico se consigue con la mezcla de pentóxido de dinitrógeno y agua. Al sintetizarlo de manera pura, se necesita la destilación de ácido sulfúrico, pues el ácido nítrico tiende a formar un azeótropo junto al agua en una composición de entorno al 68% de ácido nítrico y el resto de agua. Cuando la solución tiene más de un 86% de ácido nítrico, se conoce como ácido nítrico fumante, pudiendo ser de color blanco o rojo, conociéndose al blanco como, 100% pues apenas contiene agua. Industrialmente se fabrica a través de la síntesis del amoniaco y oxígeno. Dichos elementos se combinan en reactores con grandes proporciones con un catalizador metálico. Debido a las altas temperaturas (entre 700 y 900 ºC) que se pueden llegar a alcanzar, se deben usar metales con unas características físicas concretas, siendo generalmente el platino, en combinación con el rodio.
Es un ácido fuerte, pues en solución acusa se puede disociar por completo dando un ión nitrato y protón. Las sales de este ácido se conocen como nitratos, siendo casi todas ellas solubles en agua.
