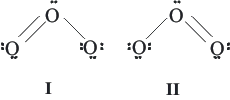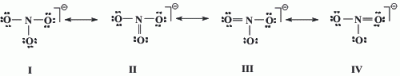Resonancia
A veces, una única estructura de Lewis no nos aporta toda la información que necesitamos de una molécula, o no nos da la información completa, por lo que necesitamos tener más de una estructura de Lewis, como por ejemplo es el caso de la molécula de ozono, de la cual podemos dibujar dos estructuras de Lewis. En el caso del ozono, sus estructuras por separado no dan una buena representación de su geometría, esto ocurre con las estructuras de numerosas otras moléculas.
Estructuras del Ozono:
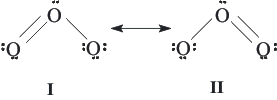
La estructura de Lewis presenta deficiencias, por lo que debemos introducir un nuevo término: la resonancia. Según el concepto de resonancia, las estructuras que tienen las moléculas pueden encontrarse representadas por la sumación o mezcla de cada una de las estructuras de Lewis que puedan presentarse para una molécula. Cuando queremos indicar que existe resonancia en la estructuras, lo haremos introduciendo una flecha de doble punta. En el caso del ozono sería:
Entenderemos por estructuras resonantes aquellas que sean una mezcla de las diferentes estructuras existentes para una molécula, pero no debemos confundirlo con los equilibrios entre ellas o los cambios intermoleculares. Si nos referimos a la mecánica cuántica, la distribución a nivel electrónico con la que cuentan cada una de las estructuras moleculares será representada a través de una función de onda siendo, para una molécula Y, la función de onda real un combinado lineal de todas las funciones de onda que tienen las diferentes estructuras resonantes que posee la molécula a tratar. A las estructuras resonantes también se las conoce como formas canónicas. En el caso del ejemplo que nos ocupa, en el ozono, ambas funciones de onda para cada una de las dos estructuras contribuye de la misma manera a la función de onda real de la molécula de ozono (ψ), pues en este caso, ambas cuenta con la misma energía, por lo cual se dice que la estructura global es un híbrido de resonancia.
La resonancia presenta dos importantes consecuencias, por un lado nos habla de las características que presentan los enlaces dentro de la molécula, y por otro lado nos reduce la energía que posee el híbrido de resonancia, por lo cual dicha energía siempre será menor que las de las estructuras que participan. De esta forma, por ejemplo, la energía que tiene el híbrido de resonancia para el ozono (O3), será menor que la tienen cada uno de las estructuras en resonancia individualmente.
El concepto de resonancia es más importante cuanto mayor sea el número de estructuras contribuyentes en energía. En dichos casos, el total de las estructuras resonantes ayudan de igual manera al híbrido de resonancia. Pero cuando las diferentes estructuras resonantes poseen distintas energías, su aporte al híbrido de resonancia tendrá menor importancia según sea mayor la energía que tiene la estructura. Es decir, las estructuras resonantes que tienen menor energía se parecen más a la formación real de la molécula.
La elección a tomar acerca de qué estructura de Lewis será la de menor energía, y por lo tanto, la que colabora mayoritariamente al híbrido de resonancia dependerá fuertemente de la distribución que tengan las cargas formales para cada átomo de la molécula. A pesar de que la carga total que tenga la molécula se encuentre repartida de manera global a lo largo de la estructura, en algunas ocasiones se hace de utilidad poder asignar una carga formal a cada uno de los átomos de la estructura. La carga formal que tiene un átomo en las estructuras de Lewis puede ser calculada a través de la fórmula:
Cf (carga formal) = Nv (número de electrones de valencia) – Nps (número de electrones en los pares no compartidos) – ½ Npc (número de electrones compartidos)
Es decir, la carga formal será la diferencia existente entre la cantidad de electrones que hay en un átomo cuando éste se encuentra en forma libre, y la cantidad de electrones que tiene cuando se encuentra formando parte de una molécula. Así las cargas formales nos indican la cantidad de electrones que un átomo puede ganar o perder cuando éste se encuentra implicado en un enlazamiento de tipo covalente con algún otro átomo. Cuando sumamos las cargas formales de una estructura de Lewis, siempre será de igual valor que la carga total que posee la molécula o especie química.
La estructura resonante que tiene la energía más pequeña es la que tiene sus cargas formales en átomos solitarios más pequeñas. De igual modo, los átomos con mayor electronegatividad son los que tienen cargas más negativas, y los que poseen menor electronegatividad son las que cuentan con cargas positivas. Por ejemplo, el caso del NO3- :