Orden de enlace
El orden de enlace se puede definir como el número de enlaces existentes entre dos átomos. Por ejemplo el orden de enlace en N2, N≡N es tres. En el caso de la molécula de acetileno H-C≡C-H el orden de enlace entre los átomos de carbono es 3, y entre los átomos de hidrógeno y los de carbono, es 1.
El orden de enlace está muy relacionado con la longitud del enlace y la energía del mismo. Por lo general, a mayor orden de enlace, mayor es la energía y la fuerza de dicho enlace y menor su longitud. Estos factores también están asociados a la estabilidad de un enlace.
De acuerdo con las teorías cuánticas, el orden de enlace puede no ser un número entero. Esto se debe a que según la teoría de los orbitales moleculares, el orden de enlace se puede definir como el resultado del siguiente cálculo:
![]()
Pongamos por ejemplo la molécula de benceno. En 1865 Kekulé propuso que dicha molécula podría tener una configuración como se muestra en la figura de abajo, como un anillo compuesto por seis carbonos, tres de ellos unidos por enlaces dobles y tres por enlaces sencillos. Según este esquema, los enlaces entre los carbonos no serían todos de la misma longitud, ya que los enlaces dobles son más cortos y los sencillos más largos.
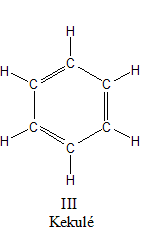
Sin embargo, más tarde se comprobó experimentalmente que la longitud del enlace entre los carbonos del anillo de benceno es la misma siempre, los enlaces son todos iguales, y el anillo es plano. Esto se explica mediante la teoría de orbitales moleculares, en donde los seis electrones deslocalizados forman enlaces pi a lo largo de todo en anillo, constituido por seis átomos de carbono, lo que resultaría en un orden de enlace 0.5 para cada carbono. Si a este orden le sumamos los enlaces sigma entre carbonos, tenemos que el enlace carbono-carbono es de 1.5, un enlace un poco más corto que en enlace sencillo, pero más largo que un doble enlace.
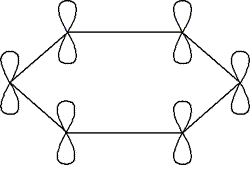
Esta teoría de deslocalización de electrones es la que explica la mayoría de las propiedades del benceno. Dicho de otra manera, y como se puede ver en la figura que sigue, los átomos del anillo se enlazan entre ellos por medio de la hibridación de orbitales sp2, formando enlaces sencillos. Cada átomo tendría un orbital p sin hibridar, perpendicular al plano del anillo. Según Kekulé, estos electrones serian los que forman los enlaces dobles, sin embargo lo que realmente hacen es deslocalizarse a lo largo de la estructura, dando como resultado el orden de enlace antes mencionado de 1.5.
Por esta razón es que la estructura real del benceno es un híbrido de resonancia entre estas dos estructuras:
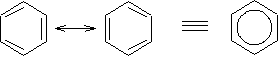
De manera que los electrones p están deslocalizados a lo largo de la estructura, y por tanto el orden de enlace carbono-carbono es aproximadamente 1.1/2.
