Átomo cúbico
La teoría del átomo cúbico fue formulada por Gilbert N.Lewis, en el año 1902. Es uno de los primeros modelos atómicos descritos, y fue desarrollado para explicar el fenómeno de los electrones de valencia. En este modelo atómico, los electrones de valencia se encuentran ubicados en los vértices de un hipotético cubo, que representa el átomo en cuestión. En la siguiente figura tenemos representados los elementos de la segunda fila de la tabla periódica, con sus electrones de valencia:
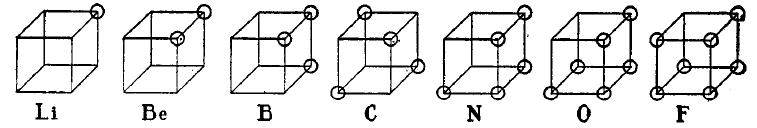
En la actualidad este modelo sólo tiene importancia desde el punto de vista histórico, ya que pronto fue sustituído por el modelo atómico de la mecánica cuántica, basado en la teoría de los orbitales atómicos. Pero en su momento, el modelo cúbico fue importante para el entendimiento los enlaces químicos.
En un artículo llamado “The atom and the Molecule” (El átomo y la molécula), publicado en 1916 por Lewis, se describe este modelo atómico, y también se explican la regla del octeto, la estructura de Lewis y el concepto de par de electrones, como integrantes fundamentales del enlace covalente.
Palabras textuales de Lewis fueron: ”Un electrón puede forma una parte de la cáscara de dos diversos átomos y no se puede decir pertenecer a cualquiera uno exclusivamente.”
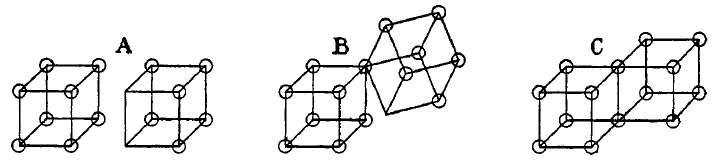
Según lo publicado por Lewis, los enlaces covalentes se forman cuando dos átomos comparten una arista, como se puede apreciar en la siguiente figura(C). En consecuencia, los electrones son compartidos por ambos átomos. Los enlaces iónicos de formarían cuando un cubo cede un electrón y otro lo gana, sin compartir aristas, como en la figura (A). Lewis también describe un enlace intermedio, cuando los cubos comparten un vértice, como en (B).
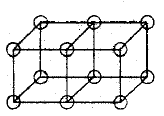
En la figura de arriba podemos observar dos átomos unidos por sus caras, lo que representaría el doble enlace, donde se comparten cuatro electrones.
Hay algunos fenómenos que no pueden ser explicados por el modelo atómico cúbico, como por ejemplo el triple enlace. Por eso el mismo Lewis sugirió que los electrones compartidos en los enlaces tienen una atracción distinta, dando como resultado una estructura en forma de tetraedro, que permite un enlace simple cuando se comparte un vértice, uno doble si se comparte una arista y explica un enlace triple cuando se comparte una cara del tetraedro, como se ve en la siguiente figura:

