Efecto mesomérico o de resonancia
Algunas moléculas pueden ser representadas por dos o más estructuras de Lewis distintas, que difieren entre ellas sólo en la posición de algunos electrones. A este fenómeno se le llama efecto mesomérico o de resonancia. En estos casos, la molécula real tiene propiedades de ambas estructuras, y se dice que es un híbrido de resonancia de ambas estructuras resonantes.
El efecto de resonancia está dado por la deslocalización de electrones, que no se encuentran en un punto fijo sino que se distribuyen de manera homogénea en la molécula, brindándole estabilidad. Por lo tanto, cuantas más estructuras resonantes tiene la molécula, más estable será.
Tomemos por ejemplo la molécula de benceno.
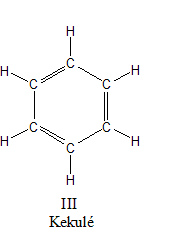
En 1865 Kekulé describió la molécula de benceno como se observa en la figura de arriba, como un anillo compuesto por seis carbonos, tres con enlaces simples y tres con enlaces dobles. Según esta descripción, existirían dos isómeros de benceno, según la posición de los enlaces dobles, como se puede observar en la siguiente figura:
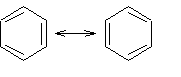
Sin embargo, la molécula real no es ninguna de éstas, sino un híbrido de resonancia entre ellas.
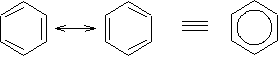
Esto se debe a que los electrones p que quedan sin hibridar en los enlaces simples, no forman dobles enlaces entre los carbonos, sino que están deslocalizados a lo largo del anillo, formando enlaces pi. El orden de enlace entre los carbonos del anillo es siempre el mismo, es 1.5.
<strong>Un poco de historia.</strong>
En el entorno del año 1928, el físico inglés Linus Pauling introduce el concepto de resonancia. El término “efecto mesomérico”o “mesomerismo”, es más popular en las publicaciones alemanas y francesas, y fue introducido por Christopher Ingold en el año 1938.
En la actualidad se prefiere usar el término deslocalización. Entonces, la energía de resonancia pasa a ser energía de deslocalización, y las estructuras de resonancia son llamadas estructuras de contribución.
Otros ejemplos de estructuras de resonancia:
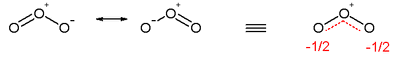
En la figura de arriba, se representa la molécula de ozono, sus estructuras de resonancia, y a la derecha la molécula real. Los átomos de oxígeno terminales son equivalentes, la carga se reparte, los electrones deslocalizados no forman doble enlace sino que se distribuyen a lo largo de la molécula.
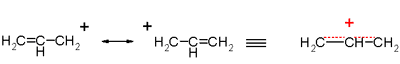
En la figura que precede se representan las estructuras de resonancia del catión del grupo alilo. La carga positiva está en realidad distribuida a lo largo del catión.
A continuación, el ejemplo del nitrometano:
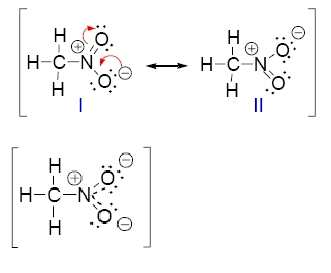
Como se puede observar, ambos átomos de oxígeno tienen la misma carga negativa.
